よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (47 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
切除可能膵癌で外科手術を行った患者は、年間 515 例(内訳は 18 歳以上 70 歳未満が 288 例、70 歳以
上 75 歳以下が 227 例)であった。
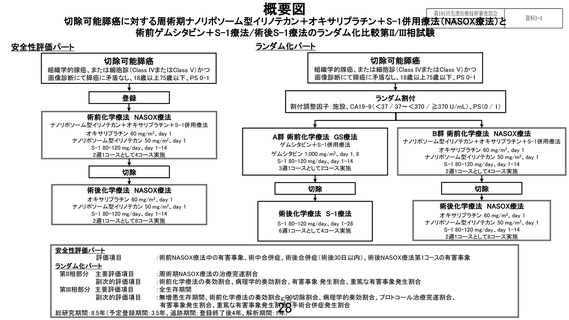
JCOG 肝胆膵グループでは先行して JCOG2101C「高齢者切除可能膵癌に対する術前ゲムシタビン+S1 療法と術前ゲムシタビン+ナブパクリタキセル療法のランダム化比較第 III 相試験」
、JCOG2202「切
除可能膵癌に対する腹腔鏡下膵体尾部切除術の開腹膵体尾部切除術に対する非劣性を検証するランダ
ム化比較第 III 相試験」が実施されている。本試験の対象患者のうち、70 歳以上 75 歳以下の切除可
能膵癌は JCOG2101C、切除可能膵体尾部癌は JCOG2202 と対象が重複する。そのため、JCOG2101C また
は JCOG2202 と本試験の両者に参加している施設では、先行する試験を優先して登録を進めることを、
班会議などでグループ内に周知している。なお、JCOG2101C と JCOG2202 の予定登録期間はそれぞれ
2026 年 1 月まで、2027 年 3 月までを予定している。JCOG2101C、JCOG2202 との対象患者の重複によ
り、本試験の登録期間前半では 70 歳未満の切除可能膵頭部癌の登録が中心なることが想定される。70
歳未満の切除可能膵頭部癌患者の登録見込みについて、過去の報告から切除可能膵癌の 60-70%が膵頭
部癌であることを踏まえると、肝胆膵グループ 20 施設で年間 200 例程度の 70 歳未満の切除可能膵頭
部癌患者が居り、そのうち本試験の適格例を 70%と見込むと、年間 140 例が本試験の対象になると想
定される。通常、ランダム化試験は同意取得が難しいが、本試験は周術期化学療法どうしの比較試験
のため、治療モダリティが異なる試験に比べ同意取得割合が高くなることが想定される。同意取得割
合を約 60%と見積もると、年間 84 例の登録が見込まれる。
申請医療機関である国立がん研究センター東病院において、切除可能膵癌に対して試験治療と全く
同一の治療レジメンである周術期 NASOX 療法の使用実績はないため、本試験においては申請医療機関
である国立がん研究センター東病院にて計 3 例の安全性を確認した後に施設拡大を行うことや第 II
相部分で周術期 NASOX 療法の有効性と安全性を評価することから、登録を一時停止する必要がある。
一方で登録期間の後半では先行する試験との登録期間の重複がなくなり、JCOG2101C 登録終了(2026
年 1 月)後には年間 40 例の登録上乗せ、さらに JCOG2202 登録終了(2027 年 3 月)後には年間 40 例
の登録上乗せが見込まれるため、予定登録期間 3.5 年で 283 例の登録は実現可能と考える。
3. 予定登録数・登録期間・追跡期間
第Ⅱ相部分
「臨床的仮説と登録数設定根拠」で示した根拠に基づき、周術期 NASOX 療法の閾値治療完遂割合を
30%、期待治療完遂割合を 50%、α=5%(片側)、検出力 80%とすると、二項分布に基づく正確な方法に
よる NASOX 療法群の必要解析対象数は 43 例となり、若干の不適格例等を見込んで NASOX 療法群の予定
登録数を 45 例とした。
45 例を解析対象とした場合、正確な片側α=2.8%、検出力=81%である。また、実際の解析対象者数が
40 例から 45 例の時、帰無仮説が棄却されるために必要な治療完遂例はそれぞれ 18(45.0%)、18(43.9%)、
19(45.2%)、19(44.2%)、19(43.2%)、20(44.4%)となる。
主たる解析は、第 III 相試験に進めるかどうかの周術期 NASOX 療法の最低限の治療完遂のデータが
揃った後、出来るだけ速やかにデータセンターが行い、解析結果を「主たる解析レポート」としてまと
め、効果・安全性評価委員会に提出する。
「患者登録見込み」より年間登録数は約 100 例と見込まれるため、予定登録期間は 1 年とする。
第Ⅲ相部分
「 臨床的仮説と登録数設定根拠」で示した背景に基づき、A 群の OS 中央値を 36 か月と仮定し、B 群
のそれが 15 か月上回るかどうか(HR=0.706)を検出する優越性試験デザインとした場合、登録 3 年、
追跡 4 年、α=5%(片側)、検出力 75%として、Schoenfeld & Richter の方法 52 を用いて必要解析対
象数を求めると、1 群 138 例、両群計 276 例(必要イベント数 179)となる。なお、A 群の OS 中央値に
想定から乖離があった場合の必要解析対象数(必要イベント数)は表 12.7.のようになる。
表 12.7.2. 両群の OS 中央値と検出力に対応する必要解析対象数
OS 中央値
A群
30 か月
36 か月
42 か月
B群
42.5 か月
51 か月
59.5 か月
検出力
70%
220(156)
242(156)
264(156)
75%
250(178)
276(179)
302(179)
80%
288(205)
318(205)
346(206)
85%
334(238)
368(239)
404(239)
※( )内は必要イベント数
47
上 75 歳以下が 227 例)であった。
JCOG 肝胆膵グループでは先行して JCOG2101C「高齢者切除可能膵癌に対する術前ゲムシタビン+S1 療法と術前ゲムシタビン+ナブパクリタキセル療法のランダム化比較第 III 相試験」
、JCOG2202「切
除可能膵癌に対する腹腔鏡下膵体尾部切除術の開腹膵体尾部切除術に対する非劣性を検証するランダ
ム化比較第 III 相試験」が実施されている。本試験の対象患者のうち、70 歳以上 75 歳以下の切除可
能膵癌は JCOG2101C、切除可能膵体尾部癌は JCOG2202 と対象が重複する。そのため、JCOG2101C また
は JCOG2202 と本試験の両者に参加している施設では、先行する試験を優先して登録を進めることを、
班会議などでグループ内に周知している。なお、JCOG2101C と JCOG2202 の予定登録期間はそれぞれ
2026 年 1 月まで、2027 年 3 月までを予定している。JCOG2101C、JCOG2202 との対象患者の重複によ
り、本試験の登録期間前半では 70 歳未満の切除可能膵頭部癌の登録が中心なることが想定される。70
歳未満の切除可能膵頭部癌患者の登録見込みについて、過去の報告から切除可能膵癌の 60-70%が膵頭
部癌であることを踏まえると、肝胆膵グループ 20 施設で年間 200 例程度の 70 歳未満の切除可能膵頭
部癌患者が居り、そのうち本試験の適格例を 70%と見込むと、年間 140 例が本試験の対象になると想
定される。通常、ランダム化試験は同意取得が難しいが、本試験は周術期化学療法どうしの比較試験
のため、治療モダリティが異なる試験に比べ同意取得割合が高くなることが想定される。同意取得割
合を約 60%と見積もると、年間 84 例の登録が見込まれる。
申請医療機関である国立がん研究センター東病院において、切除可能膵癌に対して試験治療と全く
同一の治療レジメンである周術期 NASOX 療法の使用実績はないため、本試験においては申請医療機関
である国立がん研究センター東病院にて計 3 例の安全性を確認した後に施設拡大を行うことや第 II
相部分で周術期 NASOX 療法の有効性と安全性を評価することから、登録を一時停止する必要がある。
一方で登録期間の後半では先行する試験との登録期間の重複がなくなり、JCOG2101C 登録終了(2026
年 1 月)後には年間 40 例の登録上乗せ、さらに JCOG2202 登録終了(2027 年 3 月)後には年間 40 例
の登録上乗せが見込まれるため、予定登録期間 3.5 年で 283 例の登録は実現可能と考える。
3. 予定登録数・登録期間・追跡期間
第Ⅱ相部分
「臨床的仮説と登録数設定根拠」で示した根拠に基づき、周術期 NASOX 療法の閾値治療完遂割合を
30%、期待治療完遂割合を 50%、α=5%(片側)、検出力 80%とすると、二項分布に基づく正確な方法に
よる NASOX 療法群の必要解析対象数は 43 例となり、若干の不適格例等を見込んで NASOX 療法群の予定
登録数を 45 例とした。
45 例を解析対象とした場合、正確な片側α=2.8%、検出力=81%である。また、実際の解析対象者数が
40 例から 45 例の時、帰無仮説が棄却されるために必要な治療完遂例はそれぞれ 18(45.0%)、18(43.9%)、
19(45.2%)、19(44.2%)、19(43.2%)、20(44.4%)となる。
主たる解析は、第 III 相試験に進めるかどうかの周術期 NASOX 療法の最低限の治療完遂のデータが
揃った後、出来るだけ速やかにデータセンターが行い、解析結果を「主たる解析レポート」としてまと
め、効果・安全性評価委員会に提出する。
「患者登録見込み」より年間登録数は約 100 例と見込まれるため、予定登録期間は 1 年とする。
第Ⅲ相部分
「 臨床的仮説と登録数設定根拠」で示した背景に基づき、A 群の OS 中央値を 36 か月と仮定し、B 群
のそれが 15 か月上回るかどうか(HR=0.706)を検出する優越性試験デザインとした場合、登録 3 年、
追跡 4 年、α=5%(片側)、検出力 75%として、Schoenfeld & Richter の方法 52 を用いて必要解析対
象数を求めると、1 群 138 例、両群計 276 例(必要イベント数 179)となる。なお、A 群の OS 中央値に
想定から乖離があった場合の必要解析対象数(必要イベント数)は表 12.7.のようになる。
表 12.7.2. 両群の OS 中央値と検出力に対応する必要解析対象数
OS 中央値
A群
30 か月
36 か月
42 か月
B群
42.5 か月
51 か月
59.5 か月
検出力
70%
220(156)
242(156)
264(156)
75%
250(178)
276(179)
302(179)
80%
288(205)
318(205)
346(206)
85%
334(238)
368(239)
404(239)
※( )内は必要イベント数
47