よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
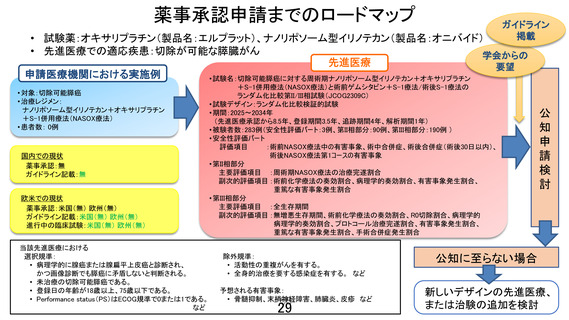
先進医療審査の事前照会事項に対する回答8
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 9 月 22 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
1. 照会3-2の回答において、「ご指摘の「8. 臨床試験の参加に伴って期待される利益と予想される
不利益」への安全性に関する記載について、安全性評価パートの結果を踏まえて追記を検討いたし
ます。」と回答いただいておりますが、いつのタイミングで、どのような追記を実施することを想定され
ていますでしょうか。
【回答】
照会事項 3-2 における「24 頁の利益不利益のところに、安全性についての記載をいつの段階で、どの
ように記載するのでしょうか。」のご指摘は、安全性評価パートにおける情報を追記することを求められ
ているものと理解しております。これについては、安全性評価パートの結果が得られ次第、改訂のタイミ
ングで同パートで確認された安全性情報とランダム化パートへの移行について追記することを想定して
います。
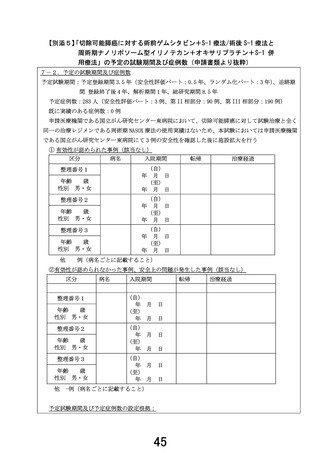
2. 安全性パートが2例ですと、安全性に課題がある症例と課題がなかった症例がそれぞれ1例ずつ
であった場合、その後の継続評価が困難であるため、奇数症例のほうが良いのではないかと思いま
すが、いかがでしょうか。
【回答】
安全性評価パートにおいて、「厚生労働大臣の定める先進医療及び施設基準の制定等に伴う手続き
等の取扱いについて」(https://www.mhlw.go.jp/web/t_doc?dataId=00tc4560&dataType=1&pageNo=1)の
第 2 の 8 に準じて、1 症例ごとに十分な検討を行うことが必要であると考えておりますが、ご指摘の通り
課題のあり・なしの人数も判断材料の 1 つになると考えますので、安全性評価パートの予定登録数を追
加して 3 例に変更させていただきます。
3. 安全性パートについて、術後 NASOX までたどり着かなかった場合、継続評価が出来かねると思
います。「プロトコルを完遂した症例」とするのはいかがでしょうか。
【回答】
ご提案の条件とする場合、以下の 2 通りの運用が考えられます。
① 初めの 3 例が登録された時点で登録を一時停止した後、例えば術前化学療法が中止となり手術を実
施できなかった例が発生した場合に登録を再開する。
23
先進医療技術名:切除可能膵癌に対する術前ゲムシタビン+S-1 療法/術後 S-1 療法と周術期ナノリポ
ソーム型イリノテカン+オキサリプラチン+S-1 併用療法
2025 年 9 月 22 日
所属・氏名:国立がん研究センター東病院 肝胆膵内科 池田 公史
1. 照会3-2の回答において、「ご指摘の「8. 臨床試験の参加に伴って期待される利益と予想される
不利益」への安全性に関する記載について、安全性評価パートの結果を踏まえて追記を検討いたし
ます。」と回答いただいておりますが、いつのタイミングで、どのような追記を実施することを想定され
ていますでしょうか。
【回答】
照会事項 3-2 における「24 頁の利益不利益のところに、安全性についての記載をいつの段階で、どの
ように記載するのでしょうか。」のご指摘は、安全性評価パートにおける情報を追記することを求められ
ているものと理解しております。これについては、安全性評価パートの結果が得られ次第、改訂のタイミ
ングで同パートで確認された安全性情報とランダム化パートへの移行について追記することを想定して
います。
2. 安全性パートが2例ですと、安全性に課題がある症例と課題がなかった症例がそれぞれ1例ずつ
であった場合、その後の継続評価が困難であるため、奇数症例のほうが良いのではないかと思いま
すが、いかがでしょうか。
【回答】
安全性評価パートにおいて、「厚生労働大臣の定める先進医療及び施設基準の制定等に伴う手続き
等の取扱いについて」(https://www.mhlw.go.jp/web/t_doc?dataId=00tc4560&dataType=1&pageNo=1)の
第 2 の 8 に準じて、1 症例ごとに十分な検討を行うことが必要であると考えておりますが、ご指摘の通り
課題のあり・なしの人数も判断材料の 1 つになると考えますので、安全性評価パートの予定登録数を追
加して 3 例に変更させていただきます。
3. 安全性パートについて、術後 NASOX までたどり着かなかった場合、継続評価が出来かねると思
います。「プロトコルを完遂した症例」とするのはいかがでしょうか。
【回答】
ご提案の条件とする場合、以下の 2 通りの運用が考えられます。
① 初めの 3 例が登録された時点で登録を一時停止した後、例えば術前化学療法が中止となり手術を実
施できなかった例が発生した場合に登録を再開する。
23