よむ、つかう、まなぶ。
2 先進医療Bに係る新規技術の科学的評価等について(別紙2)[3.7MB] (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
概要図
第181回先進医療技術審査部会
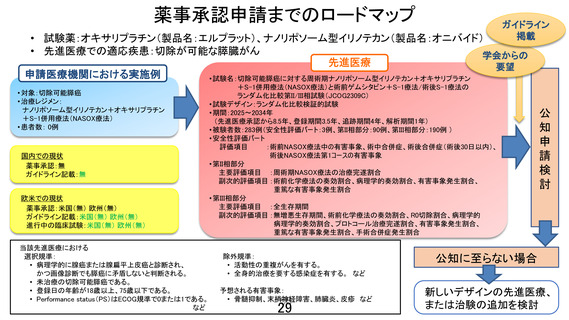
切除可能膵癌に対する周術期ナノリポソーム型イリノテカン+オキサリプラチン+S-1併用療法(NASOX療法)と
令和7年11月13日
術前ゲムシタビン+S-1療法/術後S-1療法のランダム化比較第II/III相試験
資料3-4
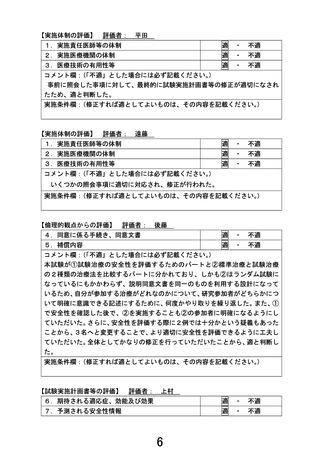
ランダム化パート
安全性評価パート
切除可能膵癌
切除可能膵癌
組織学的腺癌、または細胞診(Class IVまたはClass V)かつ
画像診断にて膵癌に矛盾なし、18歳以上75歳以下、PS 0-1
組織学的腺癌、または細胞診(Class IVまたはClass V)かつ
画像診断にて膵癌に矛盾なし、18歳以上75歳以下、PS 0-1
登録
ランダム割付
割付調整因子:施設、CA19-9(<37 / 37~<370 / ≧370 U/mL)、PS(0 / 1)
術前化学療法 NASOX療法
ナノリポソーム型イリノテカン+オキサリプラチン+S-1併用療法
オキサリプラチン 60 mg/m2、day 1
ナノリポソーム型イリノテカン 50 mg/m2、day 1
S-1 80-120 mg/day、day 1-14
2週1コースとして4コース実施
切除
A群 術前化学療法 GS療法
ゲムシタビン+S-1併用療法
ゲムシタビン 1,000 mg/m2、day 1, 8
S-1 80-120 mg/day、day 1-14
3週1コースとして2コース実施
安全性評価パート
評価項目
ランダム化パート
第II相部分 主要評価項目
副次的評価項目
第III相部分 主要評価項目
副次的評価項目
切除
切除
術後化学療法 NASOX療法
オキサリプラチン 60 mg/m2、day 1
ナノリポソーム型イリノテカン 50 mg/m2、day 1
S-1 80-120 mg/day、day 1-14
2週1コースとして8コース実施
B群 術前化学療法 NASOX療法
ナノリポソーム型イリノテカン+オキサリプラチン+S-1併用療法
オキサリプラチン 60 mg/m2、day 1
ナノリポソーム型イリノテカン 50 mg/m2、day 1
S-1 80-120 mg/day、day 1-14
2週1コースとして4コース実施
術後化学療法 NASOX療法
術後化学療法 S-1療法
S-1 80-120 mg/day、day 1-28
6週1コースとして4コース実施
オキサリプラチン 60 mg/m2、day 1
ナノリポソーム型イリノテカン 50 mg/m2、day 1
S-1 80-120 mg/day、day 1-14
2週1コースとして8コース実施
:術前NASOX療法中の有害事象、術中合併症、術後合併症(術後30日以内)、術後NASOX療法第1コースの有害事象
:周術期NASOX療法の治療完遂割合
:術前化学療法の奏効割合、病理学的奏効割合、有害事象 発生割合、重篤な有害事象発生割合
:全生存期間
:無増悪生存期間、術前化学療法の奏効割合、R0切除割合、病理学的奏効割合、プロトコール治療完遂割合、
有害事象発生割合、重篤な有害事象発生割合、手術合併症発生割合
総研究期間:8.5年(予定登録期間:3.5年、追跡期間:登録終了後4年、解析期間:1年)
- 55-
28
第181回先進医療技術審査部会
切除可能膵癌に対する周術期ナノリポソーム型イリノテカン+オキサリプラチン+S-1併用療法(NASOX療法)と
令和7年11月13日
術前ゲムシタビン+S-1療法/術後S-1療法のランダム化比較第II/III相試験
資料3-4
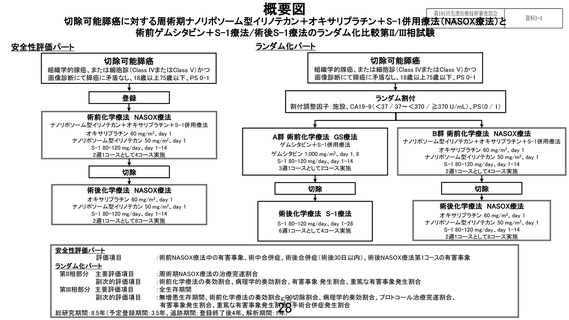
ランダム化パート
安全性評価パート
切除可能膵癌
切除可能膵癌
組織学的腺癌、または細胞診(Class IVまたはClass V)かつ
画像診断にて膵癌に矛盾なし、18歳以上75歳以下、PS 0-1
組織学的腺癌、または細胞診(Class IVまたはClass V)かつ
画像診断にて膵癌に矛盾なし、18歳以上75歳以下、PS 0-1
登録
ランダム割付
割付調整因子:施設、CA19-9(<37 / 37~<370 / ≧370 U/mL)、PS(0 / 1)
術前化学療法 NASOX療法
ナノリポソーム型イリノテカン+オキサリプラチン+S-1併用療法
オキサリプラチン 60 mg/m2、day 1
ナノリポソーム型イリノテカン 50 mg/m2、day 1
S-1 80-120 mg/day、day 1-14
2週1コースとして4コース実施
切除
A群 術前化学療法 GS療法
ゲムシタビン+S-1併用療法
ゲムシタビン 1,000 mg/m2、day 1, 8
S-1 80-120 mg/day、day 1-14
3週1コースとして2コース実施
安全性評価パート
評価項目
ランダム化パート
第II相部分 主要評価項目
副次的評価項目
第III相部分 主要評価項目
副次的評価項目
切除
切除
術後化学療法 NASOX療法
オキサリプラチン 60 mg/m2、day 1
ナノリポソーム型イリノテカン 50 mg/m2、day 1
S-1 80-120 mg/day、day 1-14
2週1コースとして8コース実施
B群 術前化学療法 NASOX療法
ナノリポソーム型イリノテカン+オキサリプラチン+S-1併用療法
オキサリプラチン 60 mg/m2、day 1
ナノリポソーム型イリノテカン 50 mg/m2、day 1
S-1 80-120 mg/day、day 1-14
2週1コースとして4コース実施
術後化学療法 NASOX療法
術後化学療法 S-1療法
S-1 80-120 mg/day、day 1-28
6週1コースとして4コース実施
オキサリプラチン 60 mg/m2、day 1
ナノリポソーム型イリノテカン 50 mg/m2、day 1
S-1 80-120 mg/day、day 1-14
2週1コースとして8コース実施
:術前NASOX療法中の有害事象、術中合併症、術後合併症(術後30日以内)、術後NASOX療法第1コースの有害事象
:周術期NASOX療法の治療完遂割合
:術前化学療法の奏効割合、病理学的奏効割合、有害事象 発生割合、重篤な有害事象発生割合
:全生存期間
:無増悪生存期間、術前化学療法の奏効割合、R0切除割合、病理学的奏効割合、プロトコール治療完遂割合、
有害事象発生割合、重篤な有害事象発生割合、手術合併症発生割合
総研究期間:8.5年(予定登録期間:3.5年、追跡期間:登録終了後4年、解析期間:1年)
- 55-
28