よむ、つかう、まなぶ。
資料2‐2 令和6年度 業務実績概要説明資料 (9 ページ)
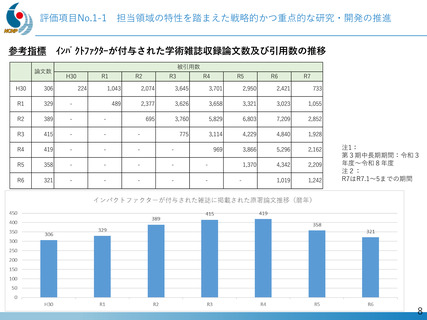
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59633.html |
| 出典情報 | 厚生労働省国立研究開発法人等審議会 高度専門医療研究評価部会(第39回 8/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
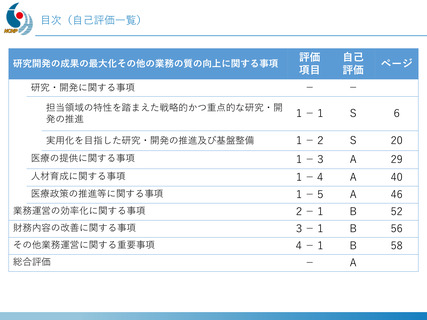
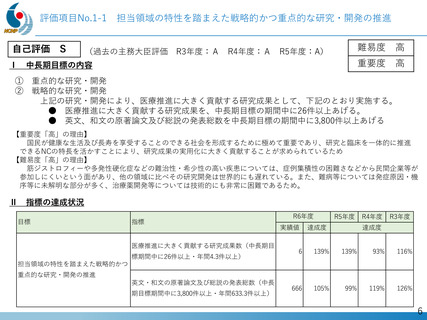
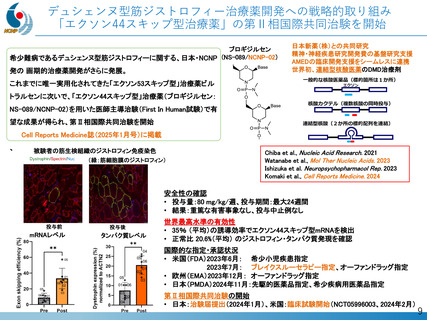
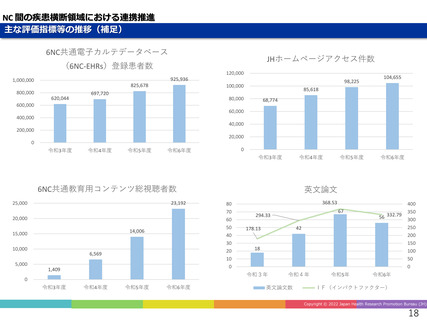
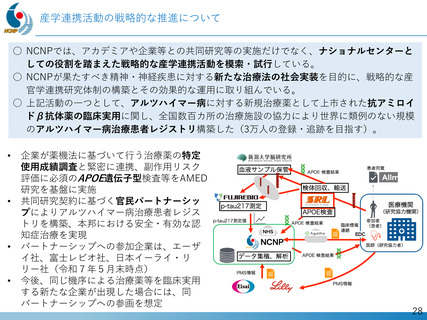
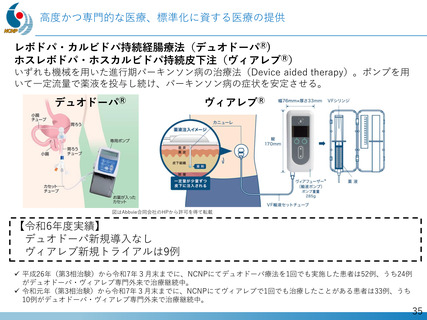
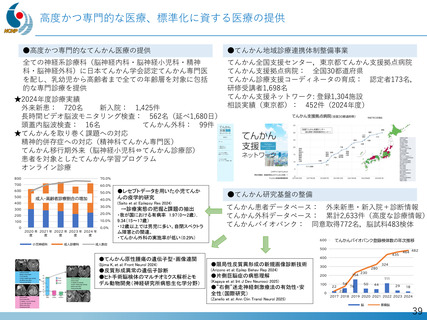
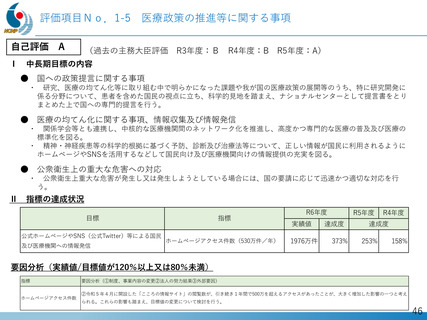
デュシェンヌ型筋ジストロフィー治療薬開発への戦略的取り組み
「エクソン44スキップ型治療薬」の第Ⅱ相国際共同治験を開始
ブロギジルセン
希少難病であるデュシェンヌ型筋ジストロフィーに関する、日本・NCNP (NS-089/NCNP-02)
発の 画期的治療薬開発がさらに発展。
日本新薬(株)との共同研究
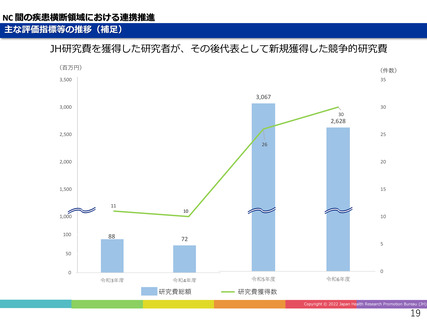
精神・神経疾患研究開発費の基盤研究支援
AMEDの臨床開発支援をシームレスに連携
世界初、連結型核酸医薬のDMD治療剤
これまでに唯一実用化されてきた「エクソン53スキップ型」治療薬ビル
トラルセンに次いで、「エクソン44スキップ型」治療薬(ブロギジルセン:
NS-089/NCNP-02)を用いた医師主導治験(First In Human試験)で有
望な成果が得られ、第Ⅱ相国際共同治験を開始
Cell Reports Medicine誌(2025年1月号)に掲載
、
被験者の筋生検組織のジストロフィン免疫染色
(緑:筋細胞膜のジストロフィン)
Chiba et al., Nucleic Acid Research. 2021
Watanabe et al., Mol Ther Nucleic Acids. 2023
Ishizuka et al. Neuropsychopharmacol Rep. 2023
Komaki et al., Cell Reports Medicine. 2024
安全性の確認
• 投与量:80 mg/kg/週、投与期間:最大24週間
• 結果:重篤な有害事象なし、投与中止例なし
投与前
mRNAレベル
投与後
タンパク質レベル
世界最高水準の有効性
• 35% (平均)の誘導効率でエクソン44スキップ型mRNAを検出
• 正常比 20.6%(平均) のジストロフィン・タンパク質発現を確認
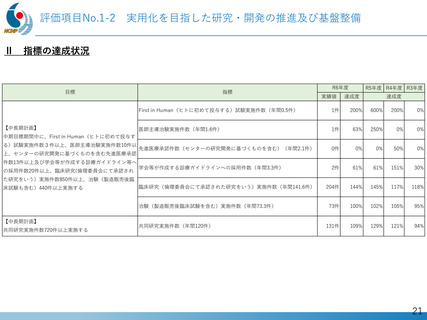
国際的な指定・承認状況
• 米国(FDA)2023年6月: 希少小児疾患指定
2023年7月: ブレイクスルーセラピー指定、オーファンドラッグ指定
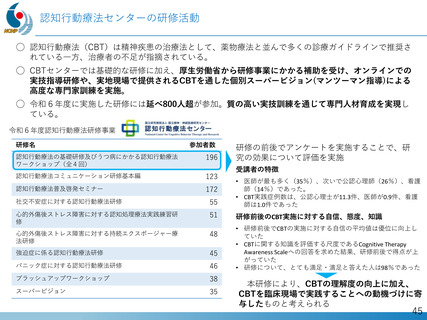
• 欧州(EMA)2023年12月: オーファンドラッグ指定
• 日本(PMDA)2024年11月:先駆的医薬品指定、希少疾病用医薬品指定
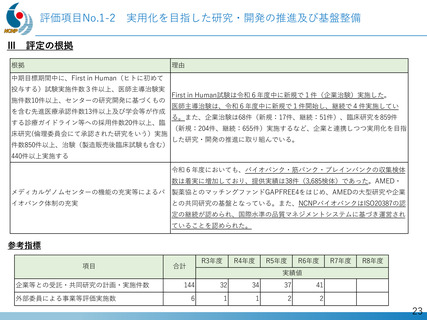
第Ⅱ相国際共同治験の開始
• 日本:治験届提出(2024年1月)、米国:臨床試験開始(NCT05996003、2024年2月)
9
「エクソン44スキップ型治療薬」の第Ⅱ相国際共同治験を開始
ブロギジルセン
希少難病であるデュシェンヌ型筋ジストロフィーに関する、日本・NCNP (NS-089/NCNP-02)
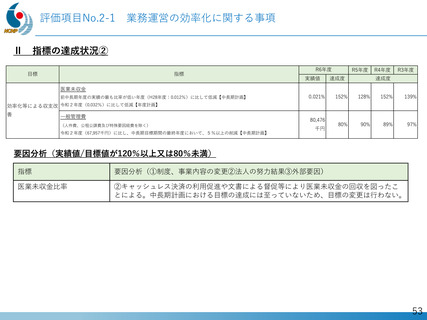
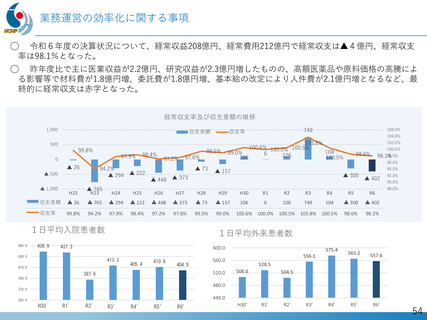
発の 画期的治療薬開発がさらに発展。
日本新薬(株)との共同研究
精神・神経疾患研究開発費の基盤研究支援
AMEDの臨床開発支援をシームレスに連携
世界初、連結型核酸医薬のDMD治療剤
これまでに唯一実用化されてきた「エクソン53スキップ型」治療薬ビル
トラルセンに次いで、「エクソン44スキップ型」治療薬(ブロギジルセン:
NS-089/NCNP-02)を用いた医師主導治験(First In Human試験)で有
望な成果が得られ、第Ⅱ相国際共同治験を開始
Cell Reports Medicine誌(2025年1月号)に掲載
、
被験者の筋生検組織のジストロフィン免疫染色
(緑:筋細胞膜のジストロフィン)
Chiba et al., Nucleic Acid Research. 2021
Watanabe et al., Mol Ther Nucleic Acids. 2023
Ishizuka et al. Neuropsychopharmacol Rep. 2023
Komaki et al., Cell Reports Medicine. 2024
安全性の確認
• 投与量:80 mg/kg/週、投与期間:最大24週間
• 結果:重篤な有害事象なし、投与中止例なし
投与前
mRNAレベル
投与後
タンパク質レベル
世界最高水準の有効性
• 35% (平均)の誘導効率でエクソン44スキップ型mRNAを検出
• 正常比 20.6%(平均) のジストロフィン・タンパク質発現を確認
国際的な指定・承認状況
• 米国(FDA)2023年6月: 希少小児疾患指定
2023年7月: ブレイクスルーセラピー指定、オーファンドラッグ指定
• 欧州(EMA)2023年12月: オーファンドラッグ指定
• 日本(PMDA)2024年11月:先駆的医薬品指定、希少疾病用医薬品指定
第Ⅱ相国際共同治験の開始
• 日本:治験届提出(2024年1月)、米国:臨床試験開始(NCT05996003、2024年2月)
9