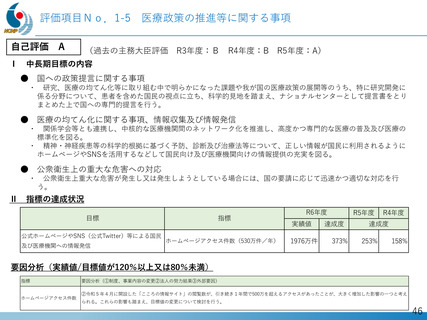
よむ、つかう、まなぶ。
資料2‐2 令和6年度 業務実績概要説明資料 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59633.html |
| 出典情報 | 厚生労働省国立研究開発法人等審議会 高度専門医療研究評価部会(第39回 8/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
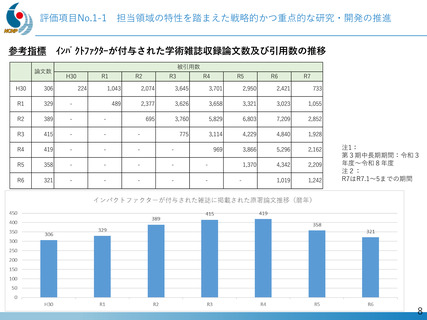
令和2年度
・・・・
令和6年度
注目
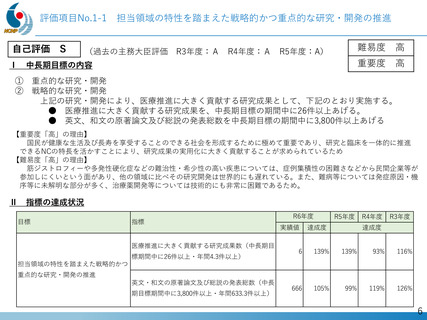
世界初!DMD治療剤ブロギジルセンの開発
医師主導治験を開始
First in human試験を医師主導治験として
1月より開始。目標症例数6例中6例が
登録された。
令和7年度以降
世界初の、デュアルターゲティング設計、エクソン44スキップ作
用機序を有するDMD治療剤、DMDのアンメットメディカルニー
ズおよびドラッグロスを克服
FiH試験の成功を受け、米国FDAからブレイクスルーセラピー指
定を受けたブロギジルセンについて、日本で第Ⅱ相試験治験届
を提出、米国で第Ⅱ相試験を開始した(NCT05996003)
第Ⅱ相日米
国際共同治験を推進
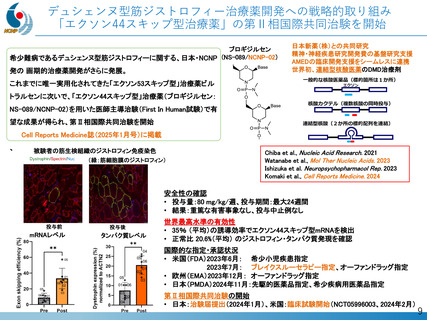
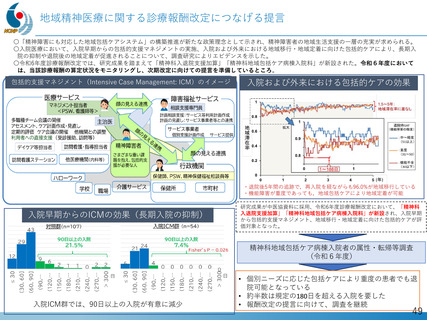
デュシェンヌ型筋ジストロフィーに対する世界初のエクソン44スキップ薬『ブロギジルセン』の開発
平成27年以降、精神・神経疾患研究開発費による基盤研究支援と、AMEDによる臨床開発支援をシームレスに連携させる体制を構築
日本新薬(株)との共同研究を通じ、世界初のエクソン44スキップ薬「ブロキジルセン」のFIH試験を医師主導治験として成功裏に完了
ブロキジルセンは、米国FDAよりブレイクスルーセラピー指定を受けた初のエクソン・スキップ薬
FIH試験成果を国際誌に公表(Cell Reports Medicine. 2025)、第Ⅱ相日米国際共同治験が進行中
【目的】
特許技術であるデュアルターゲティング設計技術を用いて、デュシェンヌ型筋ジストロフィーに対する世界初のエクソン
44スキップ薬『ブロギジルセン』の開発を行う
【成果・経過の概要】
・令和元年 日本新薬(株)と医師主導治験(第Ⅰ/Ⅱa相)に関する契約締結、治験届提出
・令和2年 First in human試験を医師主導治験として開始
・令和4年 総括報告書提出
・令和5年 米国FDAがブレイクスルーセラピー指定
・令和6年 日本で第Ⅱ相試験の治験届提出、2月米国で試験開始
10
・・・・
令和6年度
注目
世界初!DMD治療剤ブロギジルセンの開発
医師主導治験を開始
First in human試験を医師主導治験として
1月より開始。目標症例数6例中6例が
登録された。
令和7年度以降
世界初の、デュアルターゲティング設計、エクソン44スキップ作
用機序を有するDMD治療剤、DMDのアンメットメディカルニー
ズおよびドラッグロスを克服
FiH試験の成功を受け、米国FDAからブレイクスルーセラピー指
定を受けたブロギジルセンについて、日本で第Ⅱ相試験治験届
を提出、米国で第Ⅱ相試験を開始した(NCT05996003)
第Ⅱ相日米
国際共同治験を推進
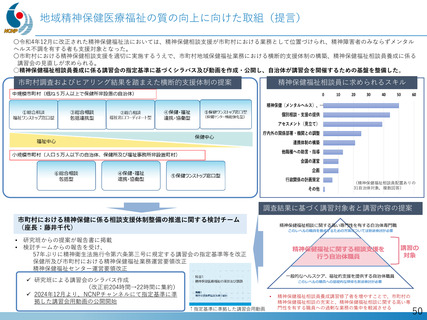
デュシェンヌ型筋ジストロフィーに対する世界初のエクソン44スキップ薬『ブロギジルセン』の開発
平成27年以降、精神・神経疾患研究開発費による基盤研究支援と、AMEDによる臨床開発支援をシームレスに連携させる体制を構築
日本新薬(株)との共同研究を通じ、世界初のエクソン44スキップ薬「ブロキジルセン」のFIH試験を医師主導治験として成功裏に完了
ブロキジルセンは、米国FDAよりブレイクスルーセラピー指定を受けた初のエクソン・スキップ薬
FIH試験成果を国際誌に公表(Cell Reports Medicine. 2025)、第Ⅱ相日米国際共同治験が進行中
【目的】
特許技術であるデュアルターゲティング設計技術を用いて、デュシェンヌ型筋ジストロフィーに対する世界初のエクソン
44スキップ薬『ブロギジルセン』の開発を行う
【成果・経過の概要】
・令和元年 日本新薬(株)と医師主導治験(第Ⅰ/Ⅱa相)に関する契約締結、治験届提出
・令和2年 First in human試験を医師主導治験として開始
・令和4年 総括報告書提出
・令和5年 米国FDAがブレイクスルーセラピー指定
・令和6年 日本で第Ⅱ相試験の治験届提出、2月米国で試験開始
10