よむ、つかう、まなぶ。
令和6年度 医療用医薬品の販売情報提供活動調査事業報告書 (9 ページ)
出典
| 公開元URL | https://www.jshp.or.jp/content/2025/0725-1.html |
| 出典情報 | 令和6年度販売情報提供活動調査事業報告書について(7/25付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
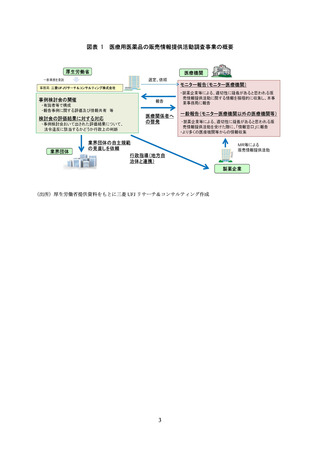
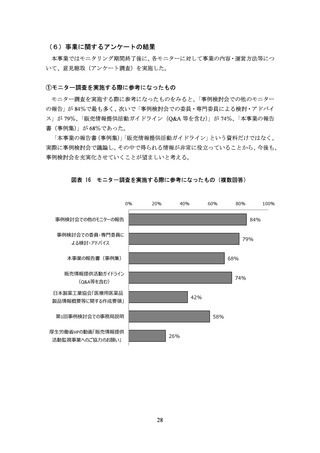
務局・厚生労働省・委員・専門委員で検討した結果をモニターに情報提供すること
とした。
事務局はモニターより収集した情報をとりまとめた上で、厚生労働省 医薬局 監
視指導・麻薬対策課に報告した。
事例検討会では各事例報告の疑義の妥当性について議論・判断を行った。疑義が妥
当と判断された報告については、報告の取り扱い(企業への指導対象としての使用、
企業名・医薬品名がわからない形式での報告書での事例掲載など)を検討した。厚
生労働省では、事例検討会の意見等を参考にしつつ、行政指導など必要な対応につ
いて最終判断を行った。
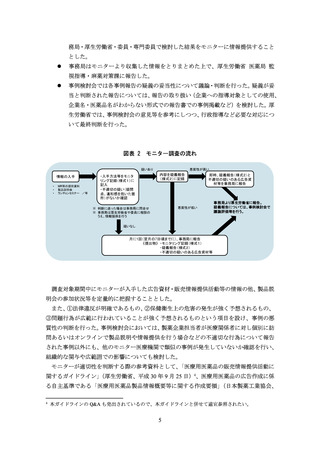
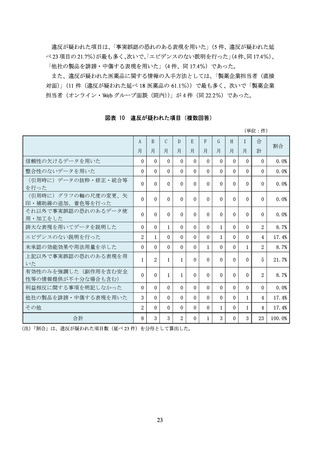
図表 2 モニター調査の流れ
疑いあり
情報の入手
•
•
•
MR等の提供資料
製品説明会
ランチョンセミナー /等
・入手方法等をモニタ
リング記録(様式1)に
記入
・不適切の疑い(疑問
点、違和感を抱いた箇
所)がないか確認
悪質性が高い
内容を疑義報告
(様式2)に記録
即時、疑義報告(様式2)と
不適切の疑いのある広告資
材等を事務局に報告
悪質性が低い
※ 判断に迷った場合は事務局に問合せ
※ 事務局は厚生労働省や委員に相談の
うえ、情報提供を行う
事務局より厚生労働省に報告。
疑義報告については、事例検討会で
議論評価等を行う。
疑いなし
月に1回(翌月の7日頃までに)、事務局に報告
《提出物》 ・モニタリング記録(様式1)
・疑義報告(様式2)
・不適切の疑いのある広告資材等
調査対象期間中にモニターが入手した広告資材・販売情報提供活動等の情報の他、製品説
明会の参加状況等を定量的に把握することとした。
また、①法律違反が明確であるもの、②保健衛生上の危害の発生が強く予想されるもの、
③問題行為が広範に行われていることが強く予想されるものという項目を設け、事例の悪
質性の判断を行った。事例検討会においては、製薬企業担当者が医療関係者に対し個別に訪
問あるいはオンラインで製品説明や情報提供を行う場合などの不適切な行為について報告
された事例以外にも、他のモニター医療機関で類似の事例が発生していないか確認を行い、
組織的な関与や広範囲での影響についても検討した。
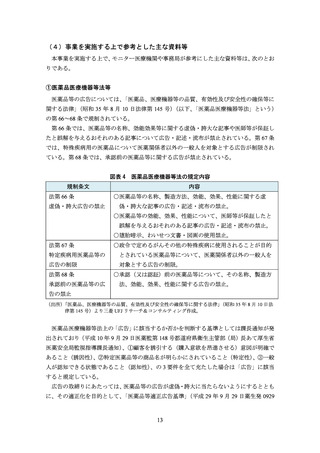
モニターが適切性を判断する際の参考資料として、
「医療用医薬品の販売情報提供活動に
関するガイドライン」
(厚生労働省、平成 30 年 9 月 25 日)4、医療用医薬品の広告作成に係
る自主基準である「医療用医薬品製品情報概要等に関する作成要領」
(日本製薬工業協会、
4
本ガイドラインの Q&A も発出されているので、本ガイドラインと併せて適宜参照されたい。
5
とした。
事務局はモニターより収集した情報をとりまとめた上で、厚生労働省 医薬局 監
視指導・麻薬対策課に報告した。
事例検討会では各事例報告の疑義の妥当性について議論・判断を行った。疑義が妥
当と判断された報告については、報告の取り扱い(企業への指導対象としての使用、
企業名・医薬品名がわからない形式での報告書での事例掲載など)を検討した。厚
生労働省では、事例検討会の意見等を参考にしつつ、行政指導など必要な対応につ
いて最終判断を行った。
図表 2 モニター調査の流れ
疑いあり
情報の入手
•
•
•
MR等の提供資料
製品説明会
ランチョンセミナー /等
・入手方法等をモニタ
リング記録(様式1)に
記入
・不適切の疑い(疑問
点、違和感を抱いた箇
所)がないか確認
悪質性が高い
内容を疑義報告
(様式2)に記録
即時、疑義報告(様式2)と
不適切の疑いのある広告資
材等を事務局に報告
悪質性が低い
※ 判断に迷った場合は事務局に問合せ
※ 事務局は厚生労働省や委員に相談の
うえ、情報提供を行う
事務局より厚生労働省に報告。
疑義報告については、事例検討会で
議論評価等を行う。
疑いなし
月に1回(翌月の7日頃までに)、事務局に報告
《提出物》 ・モニタリング記録(様式1)
・疑義報告(様式2)
・不適切の疑いのある広告資材等
調査対象期間中にモニターが入手した広告資材・販売情報提供活動等の情報の他、製品説
明会の参加状況等を定量的に把握することとした。
また、①法律違反が明確であるもの、②保健衛生上の危害の発生が強く予想されるもの、
③問題行為が広範に行われていることが強く予想されるものという項目を設け、事例の悪
質性の判断を行った。事例検討会においては、製薬企業担当者が医療関係者に対し個別に訪
問あるいはオンラインで製品説明や情報提供を行う場合などの不適切な行為について報告
された事例以外にも、他のモニター医療機関で類似の事例が発生していないか確認を行い、
組織的な関与や広範囲での影響についても検討した。
モニターが適切性を判断する際の参考資料として、
「医療用医薬品の販売情報提供活動に
関するガイドライン」
(厚生労働省、平成 30 年 9 月 25 日)4、医療用医薬品の広告作成に係
る自主基準である「医療用医薬品製品情報概要等に関する作成要領」
(日本製薬工業協会、
4
本ガイドラインの Q&A も発出されているので、本ガイドラインと併せて適宜参照されたい。
5