よむ、つかう、まなぶ。
令和6年度 医療用医薬品の販売情報提供活動調査事業報告書 (24 ページ)
出典
| 公開元URL | https://www.jshp.or.jp/content/2025/0725-1.html |
| 出典情報 | 令和6年度販売情報提供活動調査事業報告書について(7/25付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
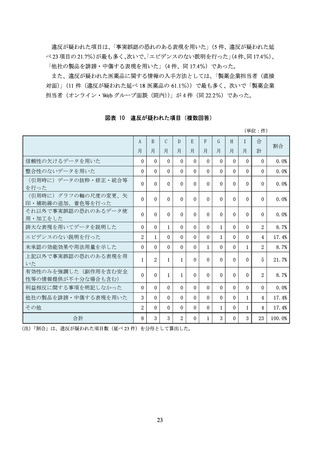
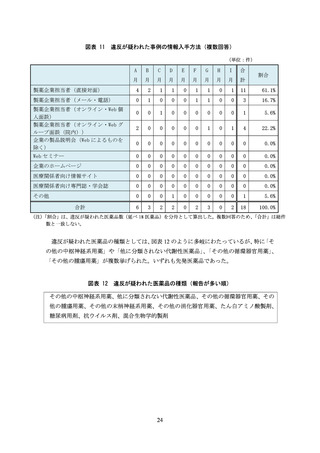
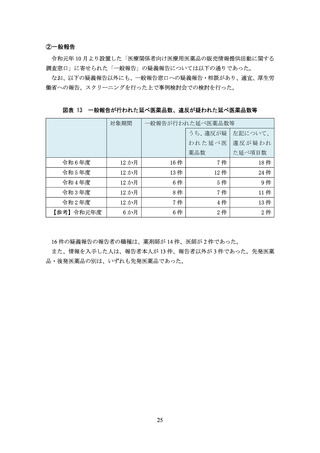
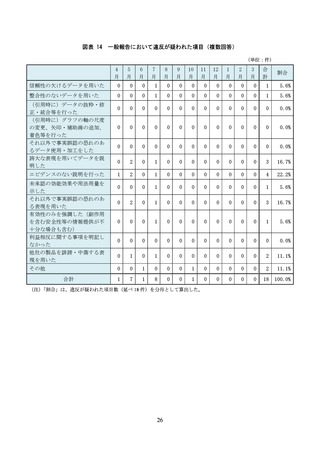
(信頼性の欠けるデータを用いた事例)
「E 社が地域の医療関係者を対象とした勉強会で、当該医薬品の『1 日の血糖変動を平坦
化する』効果を主張するパンフレットを配布していた。パンフレットには、当該医薬品
と他の医薬品について、血糖日内変動の推移と投与前後における血糖日内変動指標の変
化を比較するグラフが掲載されていたが、症例数はわずか 9 例(当該医薬品 4 例、他の
医薬品 5 例)であり統計解析も行われていなかった」
(エビデンスのない説明を行った事例)
「F 社はオーソライズド・ジェネリック(AG)の販売を開始したところであるが、同社
の MR は、自社の AG と他社の後発医薬品との差異について、
『胃炎・胃潰瘍治療剤は胃
に直接作用するため、薬剤の溶出性等の動態が重要となる。効果を最大限に得るために
は先発医薬品と製剤方法や添加物が全て同等である AG が最適である』と説明した。こ
の説明を受けた医療関係者は、後発医薬品の溶出性は承認段階では同等と認められてい
ると認識していたため、
『わずかな製剤上の差異が効果に影響するのか』と尋ねたところ、
『提示できるデータはない』と回答された。AG でない後発医薬品よりも AG の方が効能
効果が優れているようなプロモーションであり、企業全体でこのような販促方法が取り
入れられていることが危惧された」
「G 社の企業担当者から配付された文書に、
『○○剤(本剤)において、MACE や悪性腫
瘍等で死亡リスクなどが増加することもありません』と記載されていた。しかし、企業
担当者に確認したところ、
『現時点ではこれらのリスクが明確になっていないためこのよ
うな記載をした』ということであった。
『死亡リスクなどが増加することがない』という
エビデンスはなく、誤解を与える表現であった」
「H 社の企業担当者から、本剤の作用機序である***阻害剤と他の作用機序である***阻
害剤とを比較するスライドが提示された。このスライドからは、同効薬は、その機能や
遺伝的相違から 4 種類に分類されているという内容が読み取れた。企業担当者からは、
このスライドをもとに、
「本剤の作用機序は、**部位に結合するため、他の***阻害剤(3
種類)より優れている」といった説明があった。この説明後、「本剤(***阻害剤)の方
が優れているような印象を受ける説明であったが、文献やデータはあるのか」と医療従
事者が企業担当者に尋ねたところ、どちらが優れているかというデータや文献はないと
のことだった
(安全性を軽視した事例)
「I 社の当該医薬品は動物実験で胚胎児毒性があったことから、添付文書には禁忌とし
て、妊婦又は妊娠している可能性のある女性の記載があった。また、腎機能障害におい
ても用量調節が必要とされているため、適正使用ガイドにおいては投与開始前の確認事
項として 8 項目のチェックリストが作成されていた。このような投与前の確認事項があ
りながら、製品情報概要では製品特性の一つとして、投与前のスクリーニングや投与中
の臨床検査及び血中濃度測定を必要としない旨の記載があった。投与前のスクリーニン
20
「E 社が地域の医療関係者を対象とした勉強会で、当該医薬品の『1 日の血糖変動を平坦
化する』効果を主張するパンフレットを配布していた。パンフレットには、当該医薬品
と他の医薬品について、血糖日内変動の推移と投与前後における血糖日内変動指標の変
化を比較するグラフが掲載されていたが、症例数はわずか 9 例(当該医薬品 4 例、他の
医薬品 5 例)であり統計解析も行われていなかった」
(エビデンスのない説明を行った事例)
「F 社はオーソライズド・ジェネリック(AG)の販売を開始したところであるが、同社
の MR は、自社の AG と他社の後発医薬品との差異について、
『胃炎・胃潰瘍治療剤は胃
に直接作用するため、薬剤の溶出性等の動態が重要となる。効果を最大限に得るために
は先発医薬品と製剤方法や添加物が全て同等である AG が最適である』と説明した。こ
の説明を受けた医療関係者は、後発医薬品の溶出性は承認段階では同等と認められてい
ると認識していたため、
『わずかな製剤上の差異が効果に影響するのか』と尋ねたところ、
『提示できるデータはない』と回答された。AG でない後発医薬品よりも AG の方が効能
効果が優れているようなプロモーションであり、企業全体でこのような販促方法が取り
入れられていることが危惧された」
「G 社の企業担当者から配付された文書に、
『○○剤(本剤)において、MACE や悪性腫
瘍等で死亡リスクなどが増加することもありません』と記載されていた。しかし、企業
担当者に確認したところ、
『現時点ではこれらのリスクが明確になっていないためこのよ
うな記載をした』ということであった。
『死亡リスクなどが増加することがない』という
エビデンスはなく、誤解を与える表現であった」
「H 社の企業担当者から、本剤の作用機序である***阻害剤と他の作用機序である***阻
害剤とを比較するスライドが提示された。このスライドからは、同効薬は、その機能や
遺伝的相違から 4 種類に分類されているという内容が読み取れた。企業担当者からは、
このスライドをもとに、
「本剤の作用機序は、**部位に結合するため、他の***阻害剤(3
種類)より優れている」といった説明があった。この説明後、「本剤(***阻害剤)の方
が優れているような印象を受ける説明であったが、文献やデータはあるのか」と医療従
事者が企業担当者に尋ねたところ、どちらが優れているかというデータや文献はないと
のことだった
(安全性を軽視した事例)
「I 社の当該医薬品は動物実験で胚胎児毒性があったことから、添付文書には禁忌とし
て、妊婦又は妊娠している可能性のある女性の記載があった。また、腎機能障害におい
ても用量調節が必要とされているため、適正使用ガイドにおいては投与開始前の確認事
項として 8 項目のチェックリストが作成されていた。このような投与前の確認事項があ
りながら、製品情報概要では製品特性の一つとして、投与前のスクリーニングや投与中
の臨床検査及び血中濃度測定を必要としない旨の記載があった。投与前のスクリーニン
20