よむ、つかう、まなぶ。
令和6年度 医療用医薬品の販売情報提供活動調査事業報告書 (51 ページ)
出典
| 公開元URL | https://www.jshp.or.jp/content/2025/0725-1.html |
| 出典情報 | 令和6年度販売情報提供活動調査事業報告書について(7/25付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
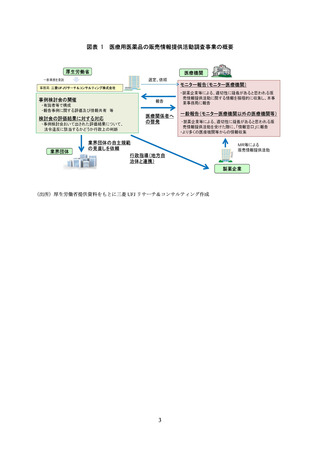
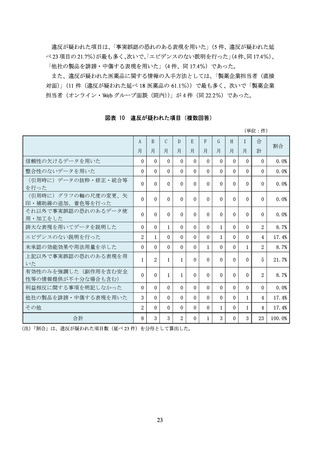
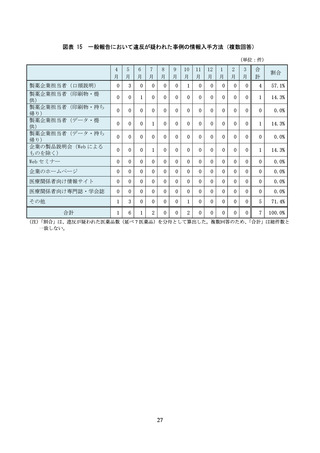
症例数が少ないデータで優位性を主張する
臨床データと関連がない非臨床データを紹介する
優位性を顕著に示せる臨床試験結果のみを紹介する
統計解析の手法や結果を記載しない
承認されていない用法用量や効能効果に関するデータを紹介する
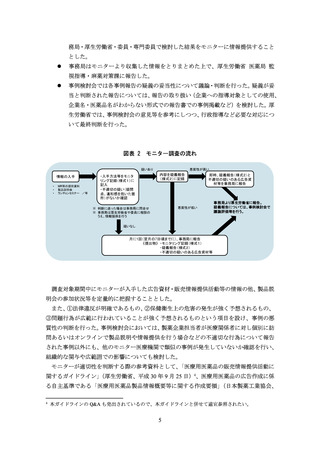
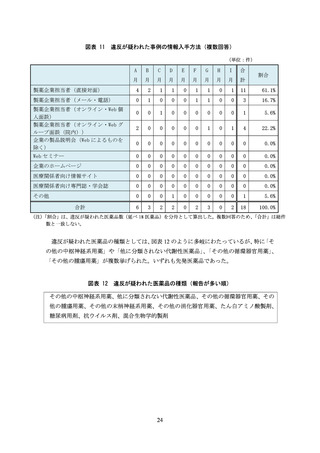
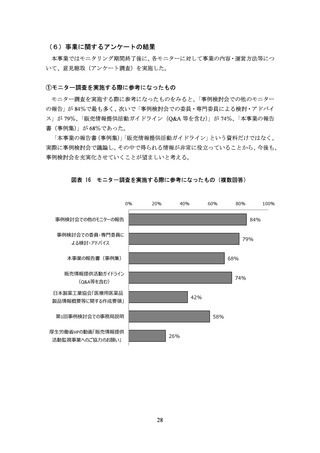
(引用文献の図表を加工した資料)
軸の最大値を調整したり、軸の尺度を変更したりして差を強調する
補助線や矢印の追加、着色等を行い、差を強調する
引用文献の図表のうち優位な部分のみを抜粋する
例)対照薬と自社製品の比較結果から自社製品のみを抜粋する、3 時点での比較結果か
ら最も差の大きい 1 時点のみを抜粋する、複数の対照薬との比較結果から特に優
位性が示せたり論旨に合ったりする対照薬のデータのみを抜粋する
主要評価項目より副次評価項目の結果を強調する
例)1 枚のスライドに主要評価項目と副次評価項目の結果を示した資料を作成。自社製
品の有意差を示せなかった主要評価項目のグラフを小さくし、有意差を示せた副
次評価項目の結果を大きくする
引用文献にないデータを追記する
例)自社製品群とプラセボ群、他剤群とプラセボ群との比較を行い、自社製品群と他剤
群との直接比較は行わない試験デザインであるにもかかわらず、論文に記載のな
い、自社製品群と他剤群との群間差推定値を追記することで両者を比較したかの
ような印象を与える
引用文献のデータの掲載順を変更する
例)複数のデータを示した棒グラフにおいて、効能効果が誇大に見えるデータや副次的
な効果を示すデータを目立つ位置に変更する
引用文献の補足事項をもとにデータを修正する
例)引用文献では盲検期・非盲検期を合わせたデータ(非盲検期に関する補足事項あり)
だったが、差が大きくなるように盲検期のみのデータに変更する
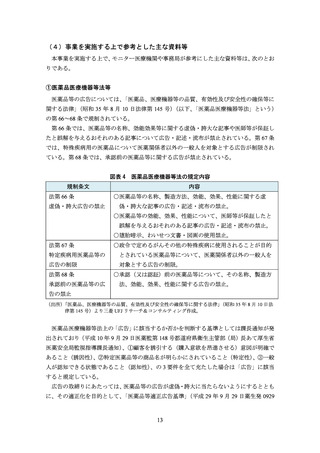
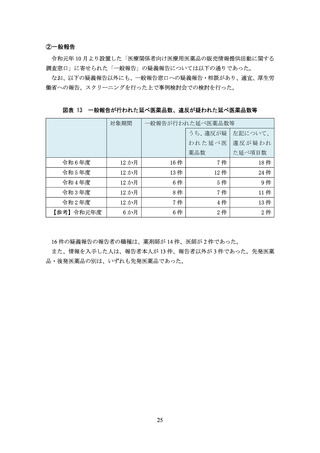
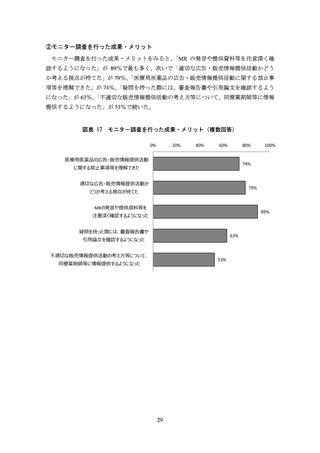
(事実誤認の恐れのある構成・表現を用いた資料)
製品説明会の趣旨とは異なる内容について説明する
例)適応追加に関する説明会で“従来の適応”に関するデータを混在させる、製品説明
会の対象でない医薬品を推奨する
明確に区別すべき情報(承認審査の対象データと非対象データ、主要評価項目と副次評
価項目、参考情報等)を区別せずに記載したり並列に扱ったりする
データを誇張したかのような見出しやタイトルを付ける
例)当該データでは示唆できない内容について「**のような傾向を示す」と見出しを
47
臨床データと関連がない非臨床データを紹介する
優位性を顕著に示せる臨床試験結果のみを紹介する
統計解析の手法や結果を記載しない
承認されていない用法用量や効能効果に関するデータを紹介する
(引用文献の図表を加工した資料)
軸の最大値を調整したり、軸の尺度を変更したりして差を強調する
補助線や矢印の追加、着色等を行い、差を強調する
引用文献の図表のうち優位な部分のみを抜粋する
例)対照薬と自社製品の比較結果から自社製品のみを抜粋する、3 時点での比較結果か
ら最も差の大きい 1 時点のみを抜粋する、複数の対照薬との比較結果から特に優
位性が示せたり論旨に合ったりする対照薬のデータのみを抜粋する
主要評価項目より副次評価項目の結果を強調する
例)1 枚のスライドに主要評価項目と副次評価項目の結果を示した資料を作成。自社製
品の有意差を示せなかった主要評価項目のグラフを小さくし、有意差を示せた副
次評価項目の結果を大きくする
引用文献にないデータを追記する
例)自社製品群とプラセボ群、他剤群とプラセボ群との比較を行い、自社製品群と他剤
群との直接比較は行わない試験デザインであるにもかかわらず、論文に記載のな
い、自社製品群と他剤群との群間差推定値を追記することで両者を比較したかの
ような印象を与える
引用文献のデータの掲載順を変更する
例)複数のデータを示した棒グラフにおいて、効能効果が誇大に見えるデータや副次的
な効果を示すデータを目立つ位置に変更する
引用文献の補足事項をもとにデータを修正する
例)引用文献では盲検期・非盲検期を合わせたデータ(非盲検期に関する補足事項あり)
だったが、差が大きくなるように盲検期のみのデータに変更する
(事実誤認の恐れのある構成・表現を用いた資料)
製品説明会の趣旨とは異なる内容について説明する
例)適応追加に関する説明会で“従来の適応”に関するデータを混在させる、製品説明
会の対象でない医薬品を推奨する
明確に区別すべき情報(承認審査の対象データと非対象データ、主要評価項目と副次評
価項目、参考情報等)を区別せずに記載したり並列に扱ったりする
データを誇張したかのような見出しやタイトルを付ける
例)当該データでは示唆できない内容について「**のような傾向を示す」と見出しを
47