規制改革実施計画のフォローアップ結果について (82 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/committee/220527/agenda.html |
| 出典情報 | 規制改革推進会議(第13回 5/27)《内閣府》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
決定
分
No.
野
令
和
2
年
7
月
17
日
医
療
・
介
護
分
野
令
和
2
年
7
月
17
日
医
療
・
介
護
分
野
令
和
2
年
7
月
17
日
医
療
・
介
護
分
野
事項名
規制改革の内容
実施時期
所管府省
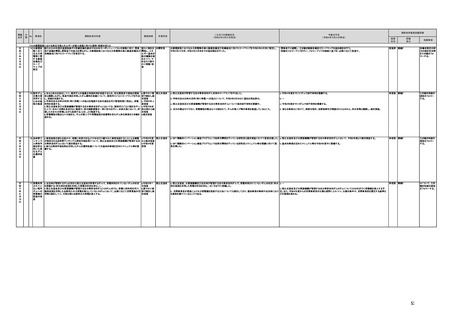
(4)一般用医薬品(スイッチOTC)選択肢の拡大
9 スイッチO 厚生労働省は、一般用医薬品の安全性・有効性の視点に加えて、国民の健康の維持・増進、医薬品 令和2年度措 厚生労働省
TC化の促 産業の活性化なども含む広範な視点から、スイッチOTC化の取組をはじめとするセルフメディケーショ 置
進に向け ンの促進策を検討するため、同省における部局横断的な体制構築を検討する。
また、上記体制において、経済性の観点も含め、スイッチOTCの推進策を検討する。具体的には、業
た推進体
制につい 界団体の意見も聞きながらスイッチOTC化の進んでいない疾患領域を明確にする。上記に基づき、ス
イッチOTCを促進するための目標を官民連携して検討・設定し、その進捗状況をKPIとして管理する。
て
促進されていない場合は原因(ボトルネック)と対策を調査し、PDCA管理する
10 一般用医
薬品への
転用の促
進
11 一般用検
査薬への
転用の促
進
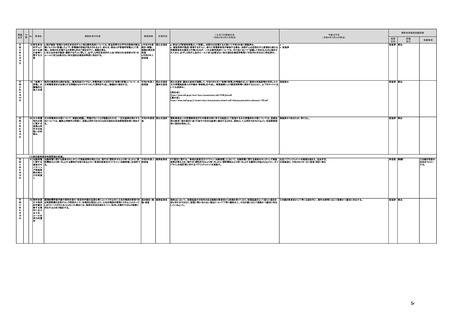
a No.9において検討された方策を踏まえつつ、セルフメディケーションを更に促進し、消費者等の多様 令和2年度措 厚生労働省
な主体の意見の反映、製薬企業の予見可能性向上という「医療用から要指導・一般用への転用に関 置
する評価検討会議」(以下「評価検討会議」という。)の本来の設置目的に資するよう、以下の対応を行
う。
・ 評価検討会議の役割は、提案のあった成分のスイッチOTC化を行う上での課題・論点等を整理し、
薬事・食品衛生審議会に意見として提示するものであり、スイッチOTC化の可否を決定するものでは
ないことを明確化する。
・ 消費者等の多様な主体からの意見が反映され、リスクだけではなく必要性についても討議できるよ
う、消費者代表を追加するなどバランスよく構成されるよう評価検討会議のメンバー構成を見直す。
・スイッチOTC化するにあたって満たすべき条件、スイッチOTC化が可能と考えられる疾患の領域、患
者(消費者)の状態や薬局・薬剤師の役割についても議論・検討し具体化する。
・ 全会一致が原則とされている評価検討会議の合意形成の在り方を見直し、賛成、反対等多様な意
見があり集約が図れない場合は、それらの意見を列挙して、薬事・食品衛生審議会に意見として提示
する仕組みとする。
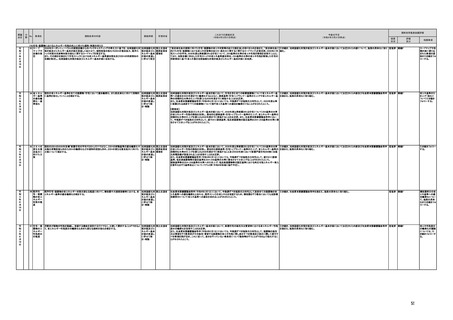
b 製薬企業が、別途、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和
35年法律第145号。以下「医薬品医療機器等法」という。)の規定により直接厚生労働大臣へ製造販売
の承認申請を行うことも可能であることを明確化する。
c スイッチOTCの製造販売承認時等に課すことのできるセルフチェックシートの作成、販売実態調査
の実施などの販売条件設定についての考え方を明確化し、真に必要であるものに限定する。
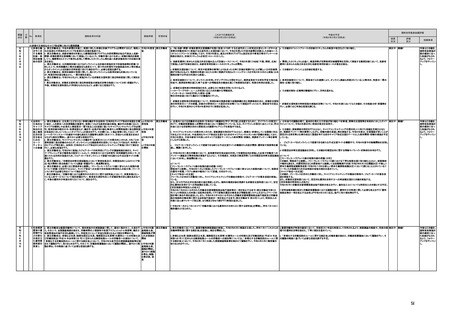
a No.9において検討された方策を踏まえつつ、近年の技術進歩も踏まえ、スイッチOTC化が可能と考
えられる検査薬の種類とそれに応じた患者(消費者)の状態や薬局・薬剤師の役割について議論・検
討の上で具体化する。その際には、自己管理が期待される領域の検査薬について、使用後の医療機
関への受診勧奨を、検査項目に応じて適切に行うこと等の方策を検討する。また、検査薬のうち、低侵
襲性であるもの、定量の数値で判定されるもの、血液検体を用いたもののOTC化の可否も含めた「一
般用検査薬の導入に関する一般原則」の見直しについて期限を定めて検討する。
b 検査薬のOTC化に当たっては、関係業界全体としてガイドライン案の提案が行われるのとは別に、
個別製薬企業からの医薬品医療機器等法の規定により直接厚生労働大臣に承認申請が行われた場
合の取扱いを明確化する。
令和2年度検 厚生労働省
討開始、結論
を得次第速や
かに措置
これまでの実施状況
(令和4年3月31日時点)
今後の予定
(令和4年3月31日時点)
規制改革推進会議評価
措置
状況
評価
区分
○令和3年4月、厚労省内に、セルフメディケーションの促進策を部局横断的に検討する担当室(セルフケア・セルフ ○セルフケア・セルフメディケーション推進のための各施策に関する工程表を、有識者や業界団体等と連携しつつ策 検討中 継続F
定予定。スイッチOTC化の推進策も含めて、更なる検討を進める予定。
メディケーション推進室)を設置した。
指摘事項
具体的な措置が
完了するまで継
続的にフォロー
を行う。
○本担当室が事務局を行う「セルフメディケーション推進に関する有識者検討会」において、セルフメディケーション
税制について、重点化すべき効果的な対象医薬品の範囲を議論し、令和4年1月から税制の対象範囲拡充を図っ
た。
今後も評価検討会議を継続的に開催し、候補成分のスイッチOTC化を行う上での課題・論点等の整理を行い、その 未措置 継続F
令和2年度末までに以下の対応を行った。
開発及び承認審査における予見性の向上に努める。
aについて
○評価検討会議では、要望成分のスイッチOTC化を行う上での課題・論点等を整理し、評価検討会議としての意見
をまとめ、薬事・食品衛生審議会に意見として提示することとし、可否の決定は行わないこととした。
○多様な意見があり集約が図れない場合は、それらの意見を整理して提示することとした。
○より多様な主体からの参加を求めることとし、評価検討会議の構成員として、消費者代表2名、産業界代表1名、
販売等関係者2名の追加を行った。
○評価検討会議における「中間とりまとめ」の中で、スイッチOTC化が可能と考えられる医薬品、薬局・薬剤師を含
む各ステークホルダーの役割等を整理した。
OTC化の実績向
上が確認できる
まで継続的に
フォローする。
bについて
○選択肢の1つとして、評価検討会議に要望を提出することなく、直接厚生労働大臣に製造販売承認申請を行うこ
とが可能であることを明確化した。
cについて
○評価検討会議における「中間とりまとめ」の中で、セルフチェックシートの要件、製造販売業者が販売時に必要な
対応などを整理した。
令和3年度は、aの改善を行った運営体制で会議を4回開催し、9つの候補成分(1つは以前の評価検討会議でス
イッチOTC化が時期尚早とされた成分)のスイッチOTC化する上での課題・論点について議論した。
なお、評価検討会議で検討済みの3成分(プロピベリン塩酸塩、ナプロキセン及びイトプリド塩酸塩)のスイッチOTC
が新たに承認された。
関係団体の意見も聴きながら、引き続き部会において一般原則に関する検討を継続する。
a,bについて
「一般用検査薬の導入に関する一般原則」について、関係団体の意見をもとに、令和3年2月12日に引き続き、令和
3年8月4日の薬事・食品衛生審議会 医療機器・体外診断用医薬品部会で議論を行った。
同部会では、関係団体から血液検体を用いる体外診断用医薬品の一般用検査薬への転用の必要性等に関する課
題の説明があり、部会委員からは、どこまでの範囲を一般用検査薬として認めるのか、OTC検査薬の検査結果を
踏まえて医療機関での受診・治療にどのようにつなげるのか、OTC検査薬の侵襲性を許容できるのか、血液検体の
使用に伴う感染症のリスクにどのように対処するか等の意見があり、引き続き議論することとした。
検討中 継続F
具体的な措置が
完了するまで継
続的にフォロー
を行う。
80