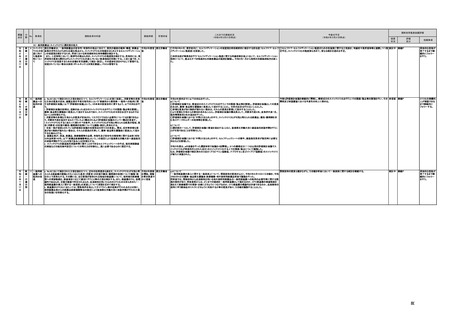
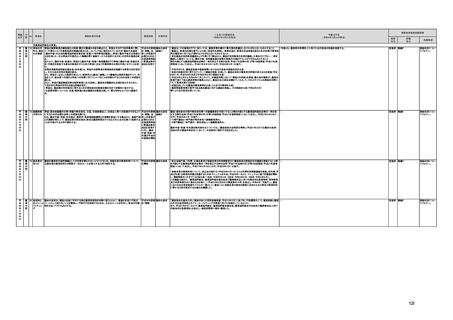
規制改革実施計画のフォローアップ結果について (26 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/committee/220527/agenda.html |
| 出典情報 | 規制改革推進会議(第13回 5/27)《内閣府》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
決定
令
和
3
年
6
月
18
日
分
No.
野
事項名
規制改革の内容
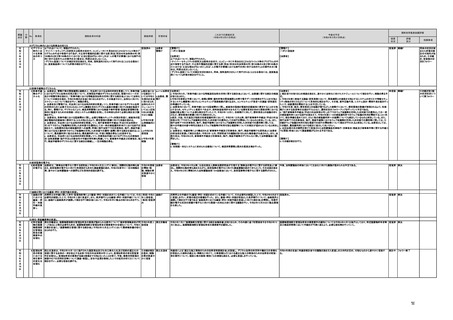
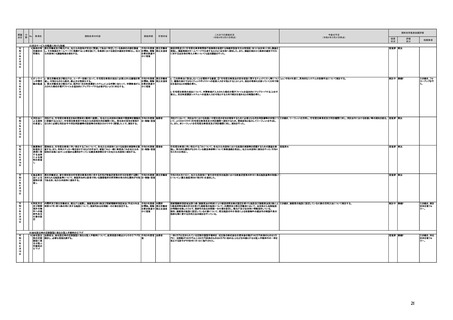
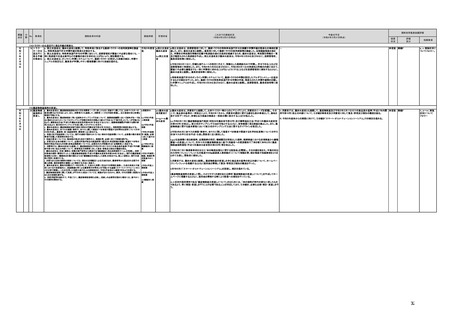
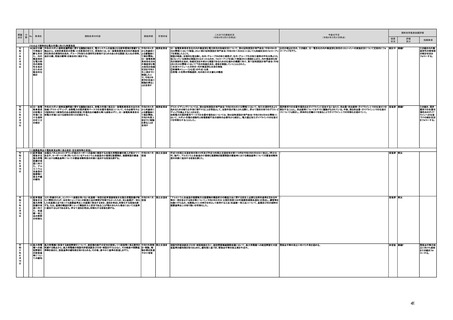
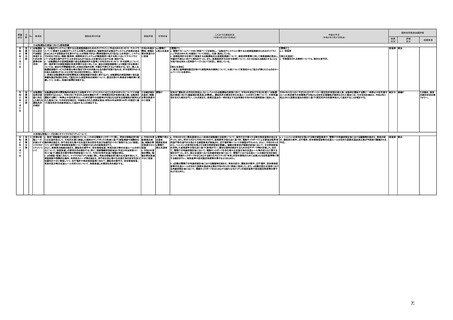
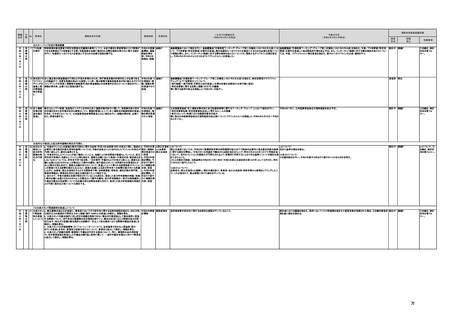
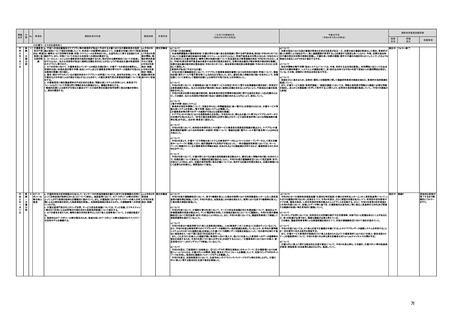
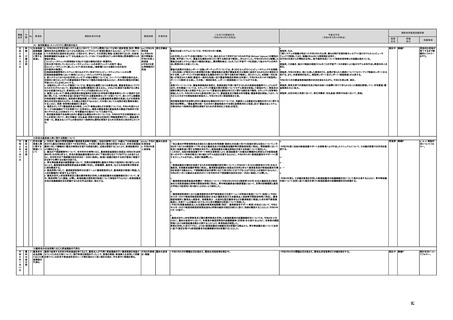
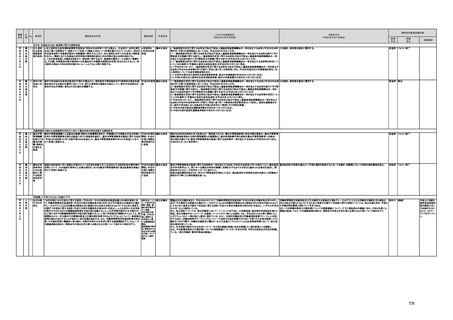
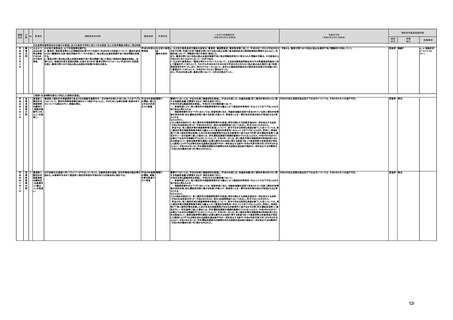
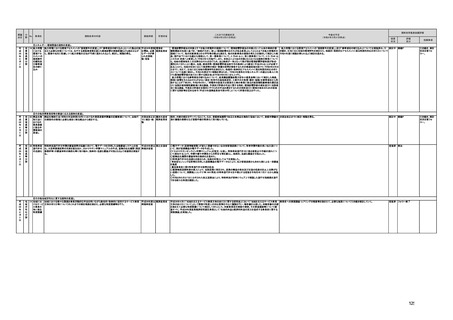
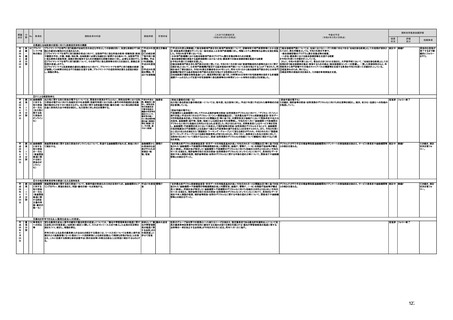
(16)最先端の医療機器の開発・導入の促進
30 最先端の a プログラム医療機器開発におけるビジネス展開の予見可能性を高めるために、医薬品医療機器等
医療機器 法上の医療機器該当性、承認手続及び保険適用の可能性について、一元的な事前相談が可能な体
の開発・ 制を整備する。また、現在、プログラム医療機器該当性に関する相談窓口である各都道府県の相談窓
導入の促 口・担当者ごとに判断にばらつきが生じないよう、データベースでの情報共有等を行うことで、統一的な
進
判断を行える体制を整備する。
b プログラムにおける、プログラム医療機器への該当性の判断が容易になるよう、既存事例の追加や
プログラム医療機器該当性の基準を明確化する。
c 厚生労働省は、各都道府県等の相談窓口でのプログラム医療機器該当性の判断結果を共有でき
るデータベースを構築し、定期的にアップデートする。加えて、相談した事業者の情報公開の同意があ
る場合には、厚生労働省のホームページで公開するなど他の事業者による閲覧を可能とする。
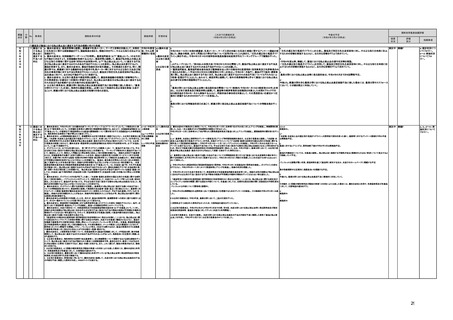
d プログラム医療機器等の開発等における萌芽的シーズを国内外の状況調査を実施することにより
早急に把握し、今までの医療機器とは異なる性質を持つプログラムとしての特性を踏まえた一定の分
類ごとに審査の考え方を整理し、分類ごとに求められるエビデンスや治験の実施方法等を明確化した
上で、具体的な評価指標を作成する。
e プログラム医療機器等の最先端の医療機器の承認審査には、従来の医療機器評価に必要とされる
知見のみならず、異なる分野(IT・プログラム・ソフトウェア)の専門性が求められることから、その審査
に特化し専門性を有した審査体制を構築する。加えて、薬事・食品衛生審議会にプログラム等に特化
した専門調査会を新設し、早期承認・実用化に向けた体制強化を行う。
f プログラム医療機器について、プログラムの特性を踏まえ、柔軟かつ迅速な承認を可能とする審査
制度を検討する。また、承認後にも継続的なアップデートが想定されるプログラム医療機器について
は、当該アップデートに係る一部変更承認申請の要否等に関するルールについても整理し、明確化す
る。
g 診療報酬上の技術料等の算定におけるプログラム医療機器の評価については、医療従事者の働き
方改革等の視点を含めて、当該プログラム医療機器を活用して患者に対して提供される医療の質の
確保・向上に係る評価の考え方を明確化する。
h プログラム医療機器を使用した医療技術について、先進医療として保険外併用療養費制度の活用
が可能であることを周知するとともに、選定療養の枠組みの適用についても検討する。
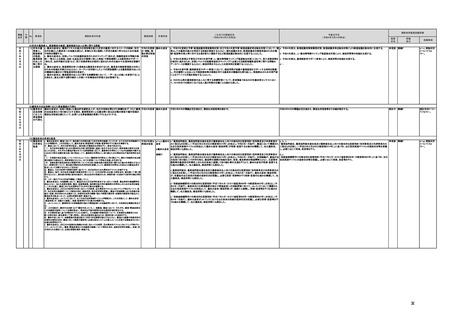
i 医療機器販売業の許可申請又は届出において、電気通信回線を通じてプログラム医療機器を提供
する事業者については、有体物の医療機器の販売を前提とした当該営業所の平面図等の提出書類の
省略を可能とするなど、真に必要なものに限定する。
j AI画像診断機器等の性能評価において、仮名加工情報を利用することの可否について検討した上
で、教師用データや性能評価用データとして求められる医療画像や患者データについて整理を行い、
当該データを仮名加工情報に加工して用いる際の手法等について具体例を示す。あわせて、仮名加
工された医療情報のみを用いて行うAI画像診断機器等の開発・研究等への「人を対象とする生命科
学・医学系研究に関する倫理指針」(令和3年文部科学省・厚生労働省・経済産業省告示第1号)の適
用の要否について整理を行い、その結果について周知する。
k 診断用プログラム医療機器等の承認申請に用いる性能評価試験において、新たに人体への侵襲や
介入を伴うことなく、既存の医療画像データや診療情報のみを利用して性能評価を行う場合において
は、当該試験を治験として実施する必要がないということを改めて明確化する。
実施時期
所管府省
これまでの実施状況
(令和4年3月31日時点)
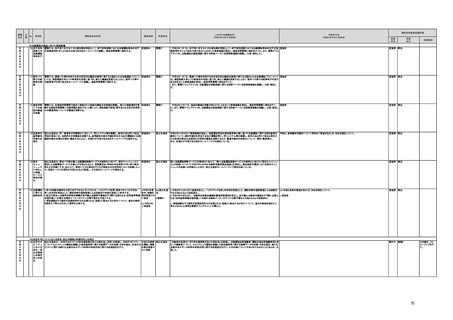
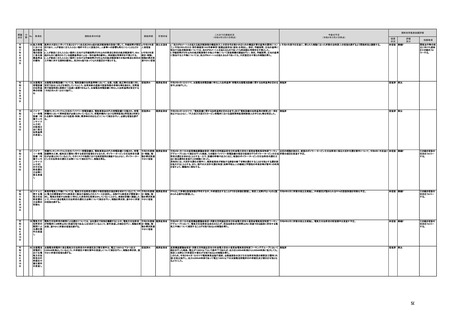
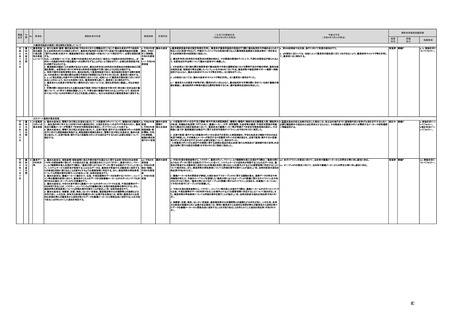
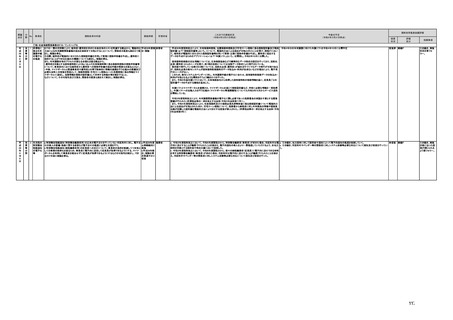
a,b,c,e:措置済 a~i、k:厚生労 【厚生労働省】
a 令和3年4月1日付けで、独立行政法人医薬品医療機器総合機構(PMDA)に、プログラム医療機器の薬事該当性、承認手続
働省
み
d,f,g,h:令和3 j:厚生労働
年度検討・結 省、個人情報
保護委員会
論
i,j,k:令和3年
度措置
ただし、「人を
対象とする生
命科学・医学
系研究に関す
る倫理指針」
に係る部分に
ついては、文
部科学省、厚
生労働省、経
済産業省
き、保険適用に関する相談を一元的に受け付ける窓口を設置した。その上で、該当性相談については、これまで各都道府県で対
応していたが、現在は原則として厚生労働省で対応している。
b. プログラムの医療機器該当性に関するガイドラインを公表した。(令和3年3月31日付け薬生機審発0331第1号・薬生監麻発
0331第15号厚生労働省医薬・生活衛生局医療機器審査管理課・監視指導・麻薬対策課二課長通知)
c. プログラムの医療機器該当性判断事例のデータベースを構築した。各都道府県に共有するとともに、事業者の同意を得た事例
についてホームページで公開している。(令和3年1月12日より公開開始)
d 令和3年度に、プログラム医療機器の国内外での開発・承認状況、規制制度等に関する調査を実施した。また、令和3年度「次
世代医療機器・再生医療等製品評価指標作成事業」において、患者の行動変容を促す治療用アプリを対象として、有効性・安全
性等を評価する際の留意事項等をまとめた評価指標(案)を作成し、令和4年3月4日にパブリックコメントを開始した。
e 令和3年4月1日付けで、厚生労働省医薬・生活衛生局医療機器審査管理課にプログラム医療機器審査管理室を設置した。ま
た、同日付けで、独立行政法人医薬品医療機器総合機構(PMDA)にプログラム医療機器審査室を設置し、プログラムに関する専
門性を有する審査員を配置した。さらに、同日付けで、薬事・食品衛生審議会医療機器・体外診断薬部会の下にプログラム医療機
器調査会を設置し、プログラムに関する専門性を有する調査員を選任した。
f 革新的なプログラム医療機器を指定し、優先的に相談、審査を行うとともに、コンシェルジュによる調整・助言等を行う制度につ
いて検討し、今後、試行的に導入することとした。
プログラム医療機器の承認事項の変更を行うに当たって、一部変更承認を受ける必要のない範囲については、既に通知で示し
ている(「医療機器プログラムの一部変更に伴う軽微変更手続き等の取扱いについて」(平成29年10月20日付け薬生機審発
1020第1号厚生労働省医薬・生活衛生局医療機器審査管理課長通知))。加えて、上述の患者の行動変容を促す治療用アプリを
対象とした評価指標(案)に、これらアプリに関する一部変更承認の要否の考え方を盛り込んだ。
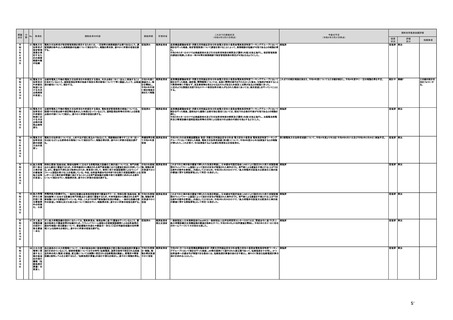
プログラム医療機器の承認事項の変更を行うに当たって、一部変更承認を受ける必要のない範囲については、既に通知で示し
ている(「医療機器プログラムの一部変更に伴う軽微変更手続き等の取扱いについて」(平成29年10月20日付け薬生機審発
1020第1号厚生労働省医薬・生活衛生局医療機器審査管理課長通知))。加えて、上述の患者の行動変容を促す治療用アプリを
対象とした評価指標(案)に、これらアプリに関する一部変更承認の要否の考え方を盛り込んだ。
g プログラム医療機器の評価については、令和4年度診療報酬改定において、
・他の医療機器と同様に、それぞれの製品の特性を踏まえ評価すること
・医師の働き方改革の観点を念頭に置きつつ、施設基準等への反映も含め評価すること
等、その評価の考え方を整理し、明確化した。
h 先進医療については、「未承認のプログラム医療機器を使用した医療技術の先進医療における取扱いの周知について」(令和3
年4月6日付厚生労働省保険局医療課事務連絡)において、プログラム医療機器を使用した医療技術について、先進医療として保
険外併用療養費制度の活用が可能であることを周知した。
選定療養の枠組みの適用については、令和4年度診療報酬改定において、プログラム医療機器を使用した医療技術のうち、保険
導入を前提としておらず、患者の選択によるものについては、選定療養の仕組みの活用がありうることを明確化した。
i 薬機法施行規則を改正し、管理医療機器プログラムのみを取り扱う営業所において、第163条第3項の規定に基づく届書への
平面図の添付を不要とした。
j.
・画像診断機器等の性能評価試験において、既存の医用画像データのみを収集し、新たに評価上必要な情報等を付ける等した上
で使用する場合は、仮名加工情報を利用したとしても薬事規制との関係で概ね問題は生じないことを確認した。(厚労省)。
・教師用データや性能評価要データとして求められる、医療画像や患者データの整理について、厚生労働科学研究費補助金 政
策科学総合研究事業(臨床研究等ICT基盤構築・人工知能実装事業 「AIを活用した医療機器の開発・研究におけるデータ利用の
実態把握と課題抽出に資する研究(21AC0701)」(令和3年度単年度研究)において、検討を行った(厚労省)。
・令和4年3月10日付けで告示した「人を対象とする生命科学・医学系研究に関する倫理指針の一部を改正する件」(令和4年文部
科学省・厚生労働省・経済産業省告示第1号)を踏まえ、仮名加工情報である医療情報のみを用いて行うAI画像診断機器等の開
発・研究等は改正指針の適用を受けることとなる旨、事務連絡(仮名加工情報である医療情報のみを用いて行うAI画像診断機器
等の開発・研究等への 生命・医学系指針の適用等について(令和4年3月31日 文部科学省研究振興局ライフサイエンス課 生命
倫理・安全対策室 厚生労働省大臣官房厚生科学課 厚生労働省医政局研究開発振興課 経済産業省商務・サービスグループ ヘ
ルスケア産業課 連名事務連絡))を発出し、周知した。
k 令和3年9月29日付けで、追加的な侵襲・介入を伴わない既存の医用画像データ等を用いた診断用医療機器の性能評価試験
について、その取扱いを明確化する通知を発出した(「追加的な侵襲・介入を伴わない既存の医用画像データ等を用いた診断用医
療機器の性能評価試験の取扱いについて」(令和3年9月29日付け薬生機審発0929第1号厚生労働省医薬・生活衛生局医療機
器審査管理課長通知))。
今後の予定
(令和4年3月31日時点)
規制改革推進会議評価
措置
状況
評価
区分
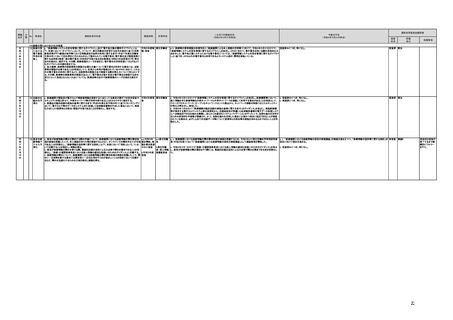
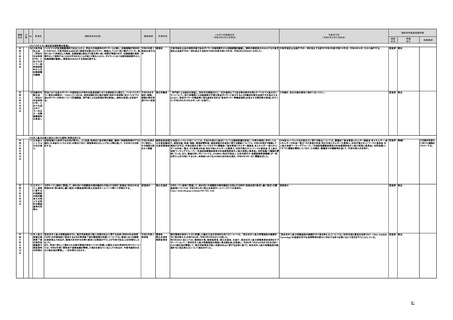
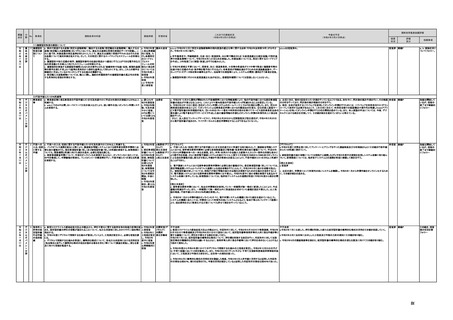
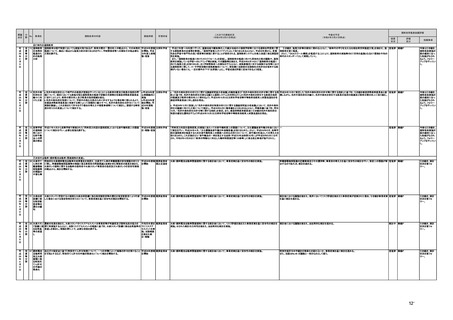
未措置 継続F
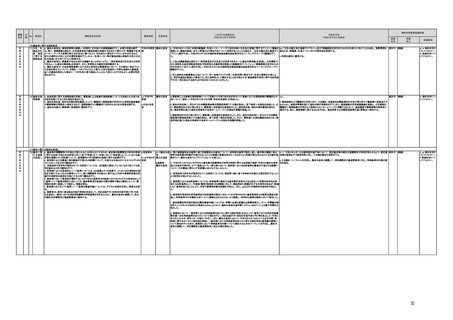
【厚生労働省】
a,b,c,e:実施済のため、特になし。
d 患者の行動変容を促す治療用アプリの評価指標について、パブリックコメント実施後、薬事・食品衛生審議会 医
療機器・体外診断薬部会に報告した上で、令和4年5月を目途に通知発出予定。
f 令和4年度上半期を目途に、革新的なプログラム医療機器を優先的に取り扱う制度を試行的に導入予定。また、
プログラム医療機器の一部変更承認の要否に関するルールについて、情報を一元化し、令和4年4月上旬を目途
に、PMDAのウェブサイトに掲載予定。
g なし
h なし
i 令和4年3月中に改正省令施行予定。
j 措置済みのため、特になし。
k 実施済のため、特になし。
指摘事項
具体的な措置が
完了するまで継
続的にフォロー
を行う。
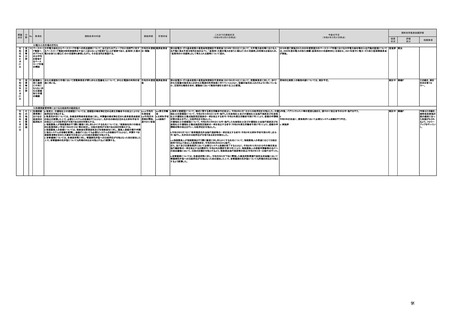
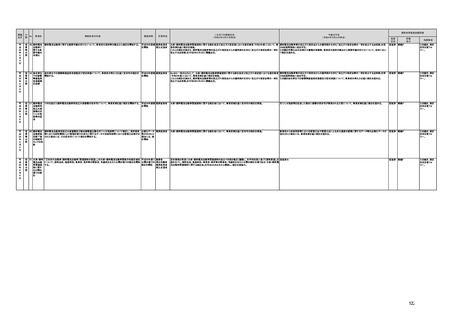
【個人情報保護委員会】
j.
・「AIを活用した医療機器の開発・研究におけるデータ利用の実態把握と課題抽出に資する研究(21AC0701)」
(令和3年度単年度研究)での整理を踏まえ、必要に応じて、「個人情報保護委員会事務局レポート仮名加工情報・
匿名加工情報編」の事例編の改訂等を検討する。
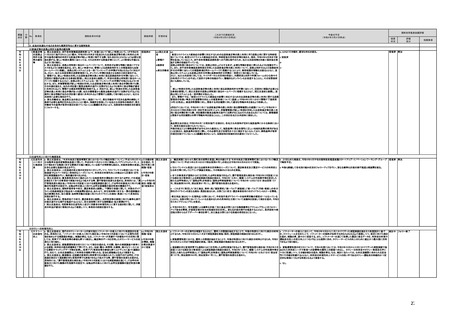
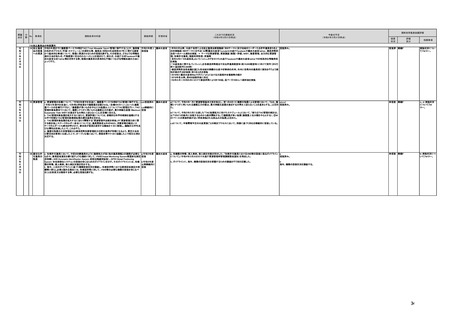
【個人情報保護委員会】
j.
・画像診断機器等の性能評価試験において、既存の医用画像データのみを収集し、新たに評価上必要な情報等を付ける等した上
で使用する場合は、仮名加工情報を利用したとしても薬事規制との関係で概ね問題は生じないことを確認した。
・教師用データや性能評価要データとして求められる、医療画像や患者データの整理について、厚生労働科学研究費補助金 政
策科学総合研究事業(臨床研究等ICT基盤構築・人工知能実装事業 「AIを活用した医療機器の開発・研究におけるデータ利用の
実態把握と課題抽出に資する研究(21AC0701」(令和3年度単年度研究)において、検討を行った。
・令和4年4月1日施行の改正個人情報保護法において、仮名加工情報制度が新設されることに伴い、個人情報を仮名加工情報
に加工して用いる際の加工手法等について具体的に説明する「個人情報保護委員会事務局レポート仮名加工情報・匿名加工情
報編」を作成し、公表を行った。
・令和4年3月10日付けで告示した「人を対象とする生命科学・医学系研究に関する倫理指針の一部を改正する件」(令和4年文部
科学省・厚生労働省・経済産業省告示第1号)を踏まえ、仮名加工情報である医療情報のみを用いて行うAI画像診断機器等の開
発・研究等は改正指針の適用を受けることとなる旨、事務連絡(仮名加工情報である医療情報のみを用いて行うAI画像診断機器
等の開発・研究等への 生命・医学系指針の適用等について(令和4年3月31日 文部科学省研究振興局ライフサイエンス課 生命
倫理・安全対策室 厚生労働省大臣官房厚生科学課 厚生労働省医政局研究開発振興課 経済産業省商務・サービスグループ ヘ
ルスケア産業課 連名事務連絡))を発出し、周知した。
24