よむ、つかう、まなぶ。
08参考資料1 ヒトパピローマウイルス(HPV)ワクチンファクトシート追補版 (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_63875.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第31回 9/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
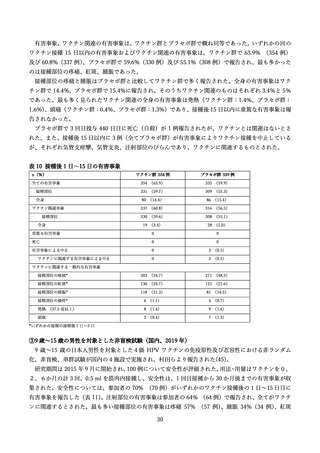
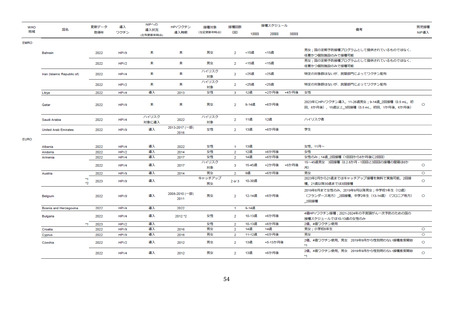
**ワクチン群の重篤な有害事象は虫垂炎、蜂窩織炎、非心原性胸痛、過敏症(ピーナッツアレルギー)、水痘関連痙攣、交通事故(2例、
死亡例)、銃創(死亡)。プラセボ群における重篤な有害事象は、交通事故に関連する外傷、死亡例として銃創(3 例)、薬剤過剰内服(2
例)、自殺(2例)、交通事故(1例)、薬物中毒(1例)
、心筋梗塞(1例)。
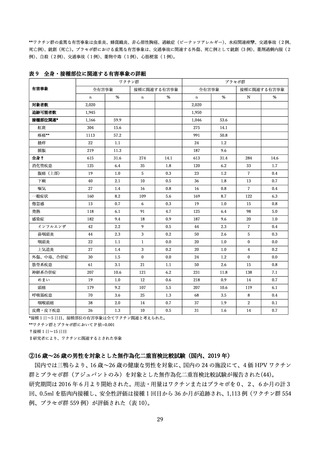
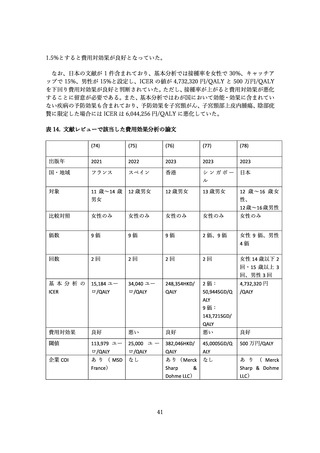
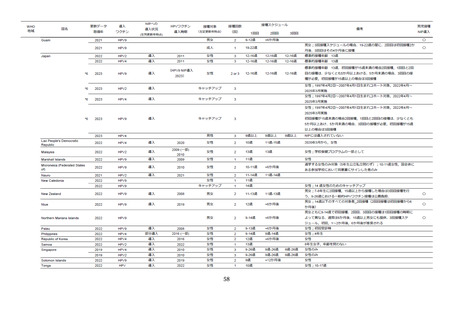
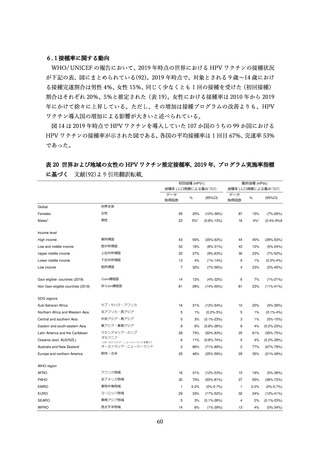
表9
全身・接種部位に関連する有害事象の詳細
ワクチン群
有害事象
全有害事象
プラセボ群
接種に関連する有害事象
n
%
n
‡
%
全有害事象
n
接種に関連する有害事象
%
対象者数
2,020
2,020
追跡可能者数
1,945
1,950
接種部位関連*
1,166
59.9
1,046
53.6
紅斑
304
15.6
275
14.1
疼痛**
1113
57.2
991
50.8
N
‡
%
掻痒
22
1.1
24
1.2
腫脹
219
11.3
187
9.6
全身†
615
31.6
274
14.1
613
31.4
284
14.6
消化管疾患
125
6.4
35
1.8
120
6.2
33
1.7
腹痛(上部)
19
1.0
5
0.3
23
1.2
7
0.4
下痢
40
2.1
10
0.5
36
1.8
13
0.7
嘔気
27
1.4
16
0.8
16
0.8
7
0.4
一般症状
160
8.2
109
5.6
169
8.7
122
6.3
倦怠感
13
0.7
6
0.3
19
1.0
15
0.8
発熱
118
6.1
91
4.7
125
6.4
98
5.0
感染症
182
9.4
18
0.9
187
9.6
20
1.0
インフルエンザ
42
2.2
9
0.5
44
2.3
7
0.4
鼻咽頭炎
44
2.3
3
0.2
50
2.6
5
0.3
咽頭炎
22
1.1
1
0.0
20
1.0
0
0.0
上気道炎
27
1.4
3
0.2
20
1.0
4
0.2
外傷、中毒、合併症
30
1.5
0
0.0
24
1.2
0
0.0
筋骨系疾患
61
3.1
21
1.1
50
2.6
15
0.8
神経系合併症
207
10.6
121
6.2
231
11.8
138
7.1
めまい
19
1.0
12
0.6
218
0.9
14
0.7
頭痛
179
9.2
107
5.5
207
10.6
119
6.1
呼吸器疾患
70
3.6
25
1.3
68
3.5
8
0.4
咽喉頭痛
38
2.0
14
0.7
37
1.9
2
0.1
皮膚・皮下疾患
26
1.3
10
0.5
31
1.6
14
0.7
*接種 1 日~5 日目、接種部位の有害事象は全てワクチン関連と考えられた。
**ワクチン群とプラセボ群において P 値=0.001
†接種 1 日~15 日目
‡研究者により、ワクチンに関連するとされた事象
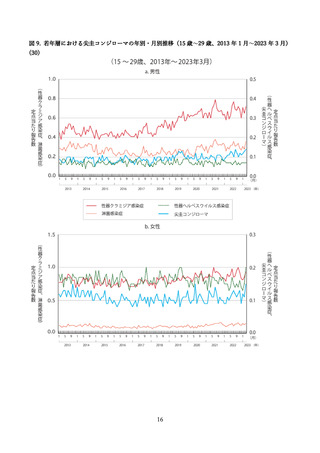
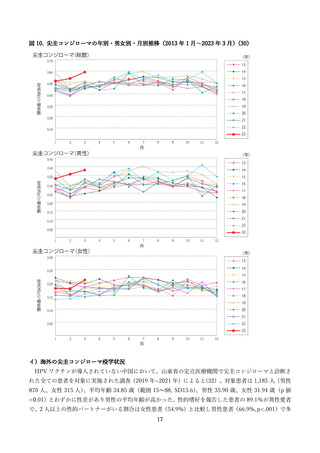
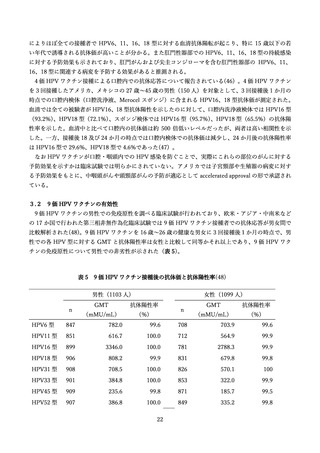
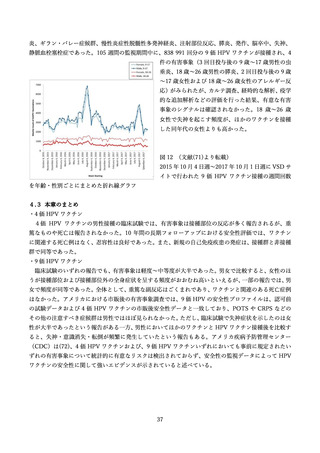
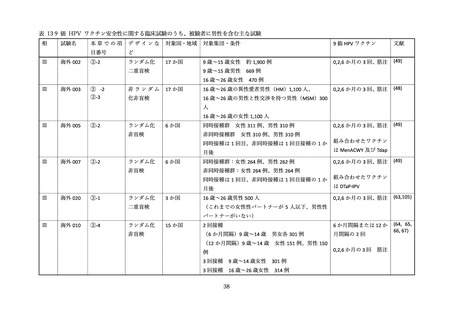
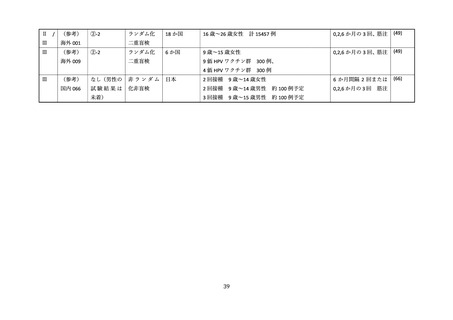
②16 歳~26 歳の男性を対象とした無作為化二重盲検比較試験(国内、2019 年)
国内では三鴨らより、16 歳~26 歳の健康な男性を対象に、国内の 24 の施設にて、4価 HPV ワクチン
群とプラセボ群(アジュバントのみ)を対象とした無作為化二重盲検比較試験が報告された(44)。
研究期間は 2016 年 6 月より開始された。用法・用量はワクチンまたはプラセボを0、2、6か月の計3
回、0.5ml を筋肉内接種し、安全性評価は接種 1 回目から 36 か月が追跡され、1,113 例(ワクチン群 554
例、プラセボ群 559 例)が評価された(表 10)
。
29
死亡例)、銃創(死亡)。プラセボ群における重篤な有害事象は、交通事故に関連する外傷、死亡例として銃創(3 例)、薬剤過剰内服(2
例)、自殺(2例)、交通事故(1例)、薬物中毒(1例)
、心筋梗塞(1例)。
表9
全身・接種部位に関連する有害事象の詳細
ワクチン群
有害事象
全有害事象
プラセボ群
接種に関連する有害事象
n
%
n
‡
%
全有害事象
n
接種に関連する有害事象
%
対象者数
2,020
2,020
追跡可能者数
1,945
1,950
接種部位関連*
1,166
59.9
1,046
53.6
紅斑
304
15.6
275
14.1
疼痛**
1113
57.2
991
50.8
N
‡
%
掻痒
22
1.1
24
1.2
腫脹
219
11.3
187
9.6
全身†
615
31.6
274
14.1
613
31.4
284
14.6
消化管疾患
125
6.4
35
1.8
120
6.2
33
1.7
腹痛(上部)
19
1.0
5
0.3
23
1.2
7
0.4
下痢
40
2.1
10
0.5
36
1.8
13
0.7
嘔気
27
1.4
16
0.8
16
0.8
7
0.4
一般症状
160
8.2
109
5.6
169
8.7
122
6.3
倦怠感
13
0.7
6
0.3
19
1.0
15
0.8
発熱
118
6.1
91
4.7
125
6.4
98
5.0
感染症
182
9.4
18
0.9
187
9.6
20
1.0
インフルエンザ
42
2.2
9
0.5
44
2.3
7
0.4
鼻咽頭炎
44
2.3
3
0.2
50
2.6
5
0.3
咽頭炎
22
1.1
1
0.0
20
1.0
0
0.0
上気道炎
27
1.4
3
0.2
20
1.0
4
0.2
外傷、中毒、合併症
30
1.5
0
0.0
24
1.2
0
0.0
筋骨系疾患
61
3.1
21
1.1
50
2.6
15
0.8
神経系合併症
207
10.6
121
6.2
231
11.8
138
7.1
めまい
19
1.0
12
0.6
218
0.9
14
0.7
頭痛
179
9.2
107
5.5
207
10.6
119
6.1
呼吸器疾患
70
3.6
25
1.3
68
3.5
8
0.4
咽喉頭痛
38
2.0
14
0.7
37
1.9
2
0.1
皮膚・皮下疾患
26
1.3
10
0.5
31
1.6
14
0.7
*接種 1 日~5 日目、接種部位の有害事象は全てワクチン関連と考えられた。
**ワクチン群とプラセボ群において P 値=0.001
†接種 1 日~15 日目
‡研究者により、ワクチンに関連するとされた事象
②16 歳~26 歳の男性を対象とした無作為化二重盲検比較試験(国内、2019 年)
国内では三鴨らより、16 歳~26 歳の健康な男性を対象に、国内の 24 の施設にて、4価 HPV ワクチン
群とプラセボ群(アジュバントのみ)を対象とした無作為化二重盲検比較試験が報告された(44)。
研究期間は 2016 年 6 月より開始された。用法・用量はワクチンまたはプラセボを0、2、6か月の計3
回、0.5ml を筋肉内接種し、安全性評価は接種 1 回目から 36 か月が追跡され、1,113 例(ワクチン群 554
例、プラセボ群 559 例)が評価された(表 10)
。
29