よむ、つかう、まなぶ。
資料2‐2 令和6年度 業務実績概要説明資料 (34 ページ)
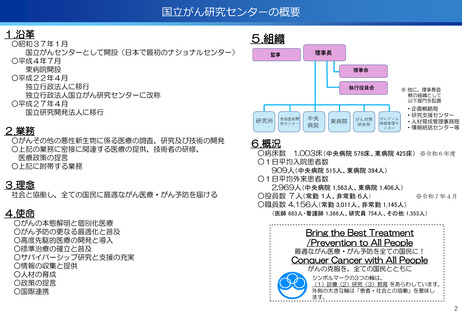
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59553.html |
| 出典情報 | 厚生労働省国立研究開発法人等審議会 高度専門医療研究評価部会(第40回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
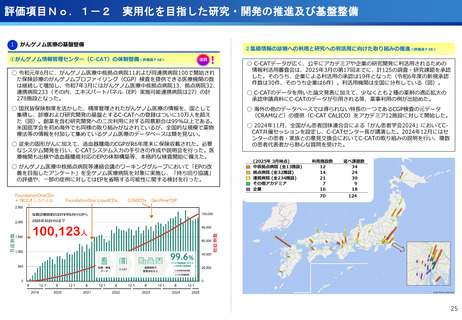
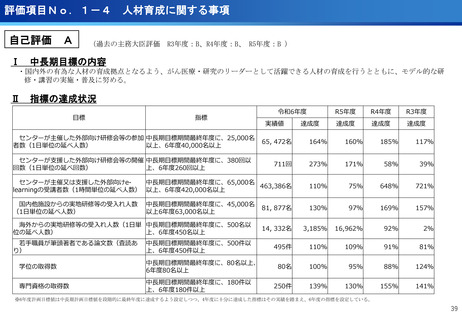
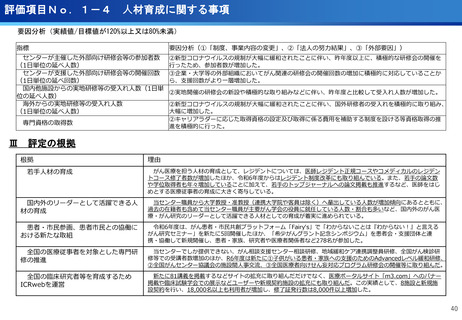
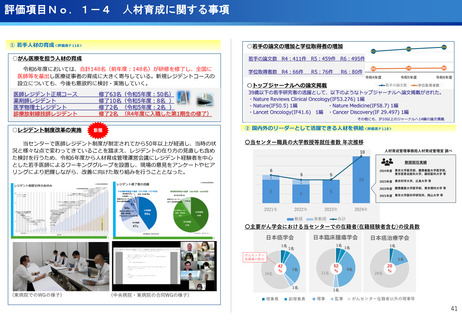
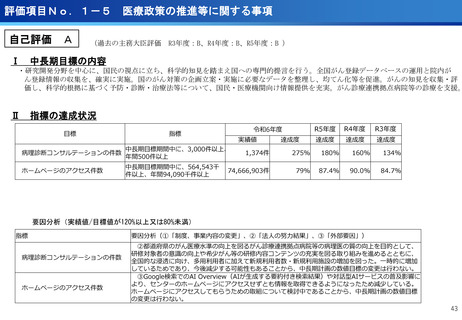
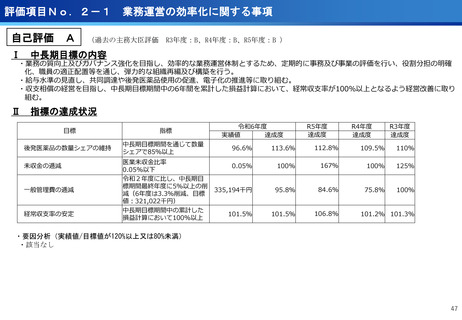
評価項目No.1-3
医療の提供に関する事項
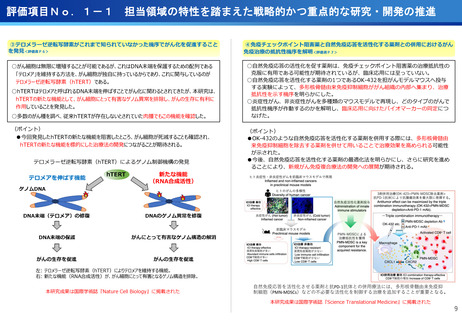
③CIRCULATE-Japan GALAXY、リキッドバイオプシーによる大腸がんの再発リスク
と術後治療効果の予測に有効性を確認<評価書P82>
④患者申出療養の推進<評価書P91> 再掲
○CIRCULATE-JapanのGALAXY試験に参加した2,240名の大腸がん患者を対象に、
ctDNA検査の結果とがんの再発リスクや生存期間を調査
〇ctDNAを調べることが大腸がんの再発リスクや生存期間を予測し、治療方針の決定
に役立つことが科学的に証明
○センターが研究代表医師を務めている患者申出療養2種類について、実施医療機関
を拡大し、症例登録数の増加を推進した。
(ポイント)
●ctDNA検査によって大腸がん患者の術後経過をより精密に予測し、術後治療の個
別化を実現する可能性がしめされた
●術後2~10週間で測定したctDNAが陽性だった患者は、陰性の患者と比べて、が
んが再発するリスクが約12倍
●ctDNA検査は、がんの遺伝子特性に関わらず、再発リスクを予測する強力なツー
ルになり得る
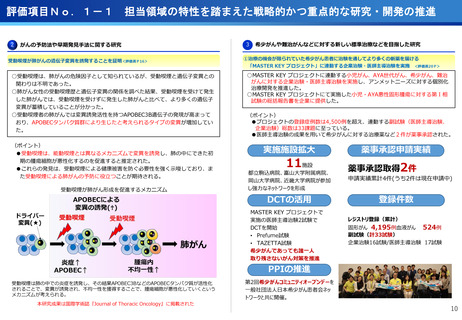
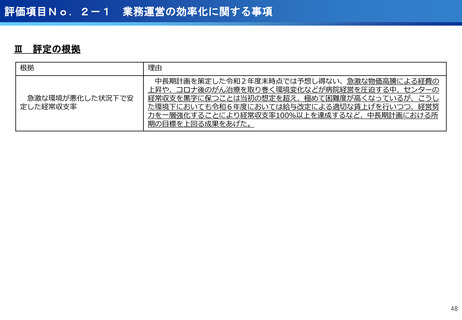
・マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子
標的治療( BELIEVE試験)
実施機関:12施設 → 13施設
R6年度登録数:113症例
対象医薬品:8社21医薬品 → 8社21医薬品
・遺伝子パネル検査結果等に基づく分子標的治療(PARTNER試験)
実施機関:1施設 → 5施設
R6年度登録数:12症例
対象医薬品:2社5医薬品 → 6社9医薬品
(ポイント)
●未承認薬、適用外使用となる薬を、薬以外の検査や診療の部分が保険診療で行え
る保険外併用療養費制度として、治験、先進医療、患者申出療養がある。
●国内で実施可能な臨床試験の対象にならない患者が一定の割合で存在し、患者の
申出を起点とする患者申出療養は、先進医療に比べ身近な医療機関で、迅速な審
査と治療を受けられるメリットがあり、センターでは患者申出療養の実績が増え
ている。
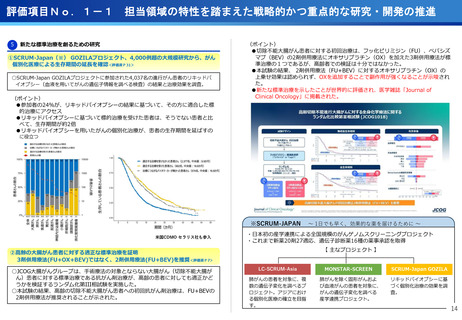
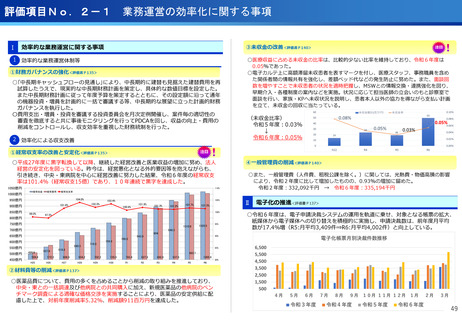
遺伝子パネル検査結果等に基づく分子標的治療(PARTNER試験)
・小児・AYA世代がん患者のドラッグアクセスの改善を目指す患者申出療養を利
用した医師主導臨床研究。
・欧米に比べ、小児がんの承認医薬品は少なく、また、小児やAYA世代のがん患
者が参加可能な臨床試験も多くない。
・小児・AYA世代がん患者のドラッグアクセスの改善を目指し、令和6年1月か
ら開始。
・これまで、実施医療機関は中央病院の1施設のみで実施しており、来院の負担
が大きかったが、実施機関を5施設に拡大し、地方でも治療が受けられるよう
になった。
34
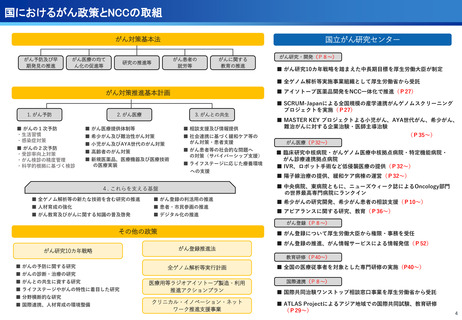
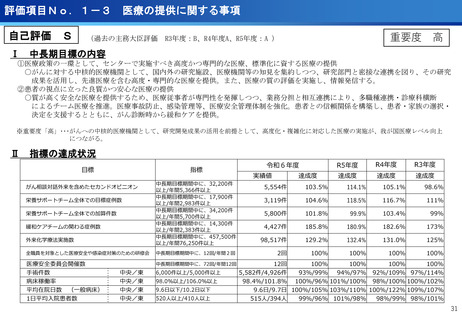
医療の提供に関する事項
③CIRCULATE-Japan GALAXY、リキッドバイオプシーによる大腸がんの再発リスク
と術後治療効果の予測に有効性を確認<評価書P82>
④患者申出療養の推進<評価書P91> 再掲
○CIRCULATE-JapanのGALAXY試験に参加した2,240名の大腸がん患者を対象に、
ctDNA検査の結果とがんの再発リスクや生存期間を調査
〇ctDNAを調べることが大腸がんの再発リスクや生存期間を予測し、治療方針の決定
に役立つことが科学的に証明
○センターが研究代表医師を務めている患者申出療養2種類について、実施医療機関
を拡大し、症例登録数の増加を推進した。
(ポイント)
●ctDNA検査によって大腸がん患者の術後経過をより精密に予測し、術後治療の個
別化を実現する可能性がしめされた
●術後2~10週間で測定したctDNAが陽性だった患者は、陰性の患者と比べて、が
んが再発するリスクが約12倍
●ctDNA検査は、がんの遺伝子特性に関わらず、再発リスクを予測する強力なツー
ルになり得る
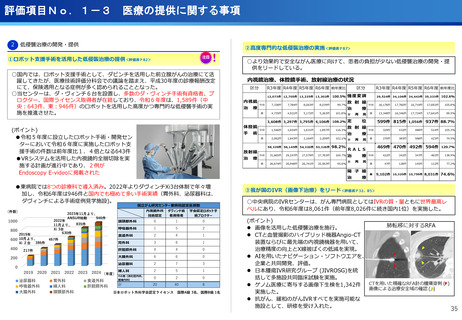
・マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子
標的治療( BELIEVE試験)
実施機関:12施設 → 13施設
R6年度登録数:113症例
対象医薬品:8社21医薬品 → 8社21医薬品
・遺伝子パネル検査結果等に基づく分子標的治療(PARTNER試験)
実施機関:1施設 → 5施設
R6年度登録数:12症例
対象医薬品:2社5医薬品 → 6社9医薬品
(ポイント)
●未承認薬、適用外使用となる薬を、薬以外の検査や診療の部分が保険診療で行え
る保険外併用療養費制度として、治験、先進医療、患者申出療養がある。
●国内で実施可能な臨床試験の対象にならない患者が一定の割合で存在し、患者の
申出を起点とする患者申出療養は、先進医療に比べ身近な医療機関で、迅速な審
査と治療を受けられるメリットがあり、センターでは患者申出療養の実績が増え
ている。
遺伝子パネル検査結果等に基づく分子標的治療(PARTNER試験)
・小児・AYA世代がん患者のドラッグアクセスの改善を目指す患者申出療養を利
用した医師主導臨床研究。
・欧米に比べ、小児がんの承認医薬品は少なく、また、小児やAYA世代のがん患
者が参加可能な臨床試験も多くない。
・小児・AYA世代がん患者のドラッグアクセスの改善を目指し、令和6年1月か
ら開始。
・これまで、実施医療機関は中央病院の1施設のみで実施しており、来院の負担
が大きかったが、実施機関を5施設に拡大し、地方でも治療が受けられるよう
になった。
34