よむ、つかう、まなぶ。
資料2‐2 令和6年度 業務実績概要説明資料 (11 ページ)
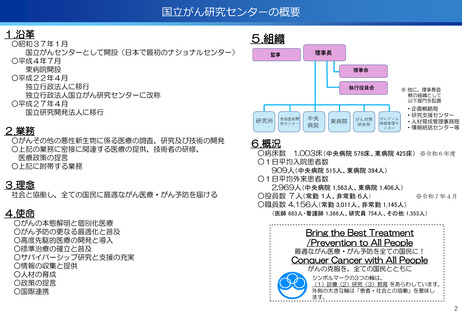
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59553.html |
| 出典情報 | 厚生労働省国立研究開発法人等審議会 高度専門医療研究評価部会(第40回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
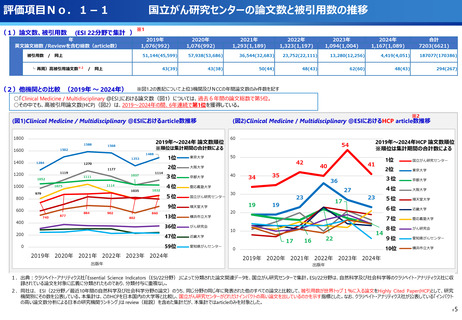
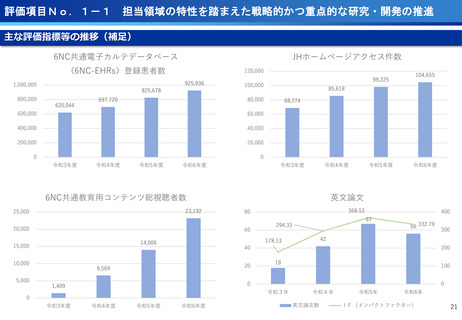
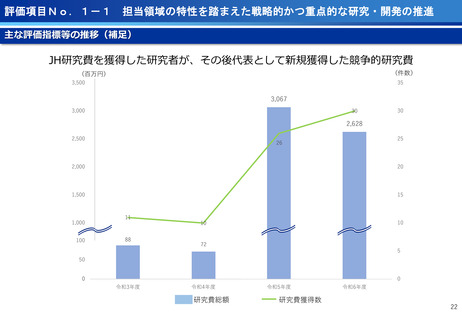
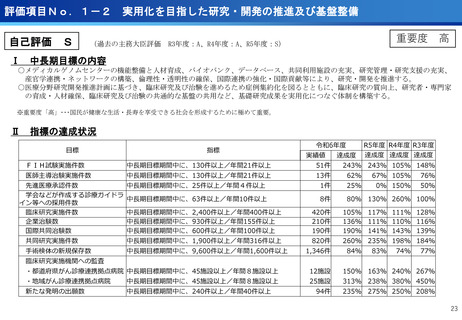
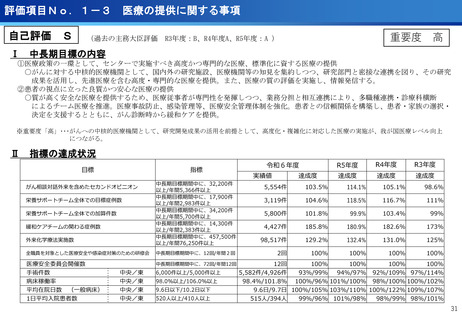
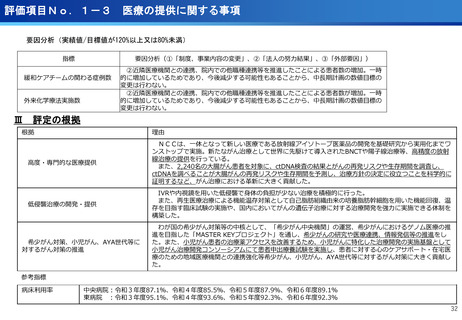
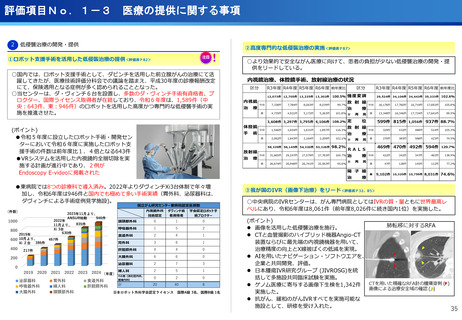
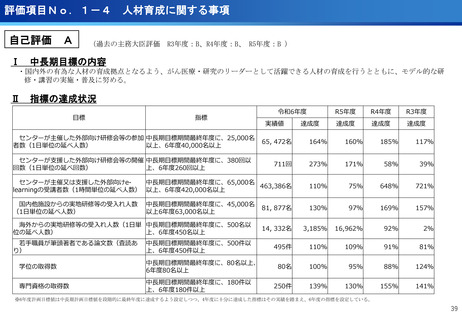
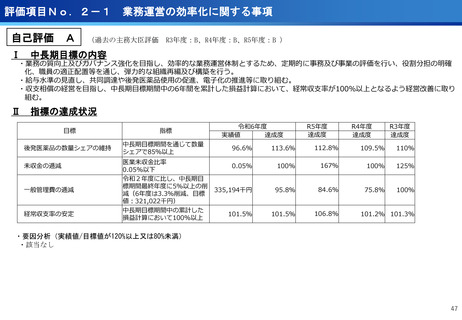
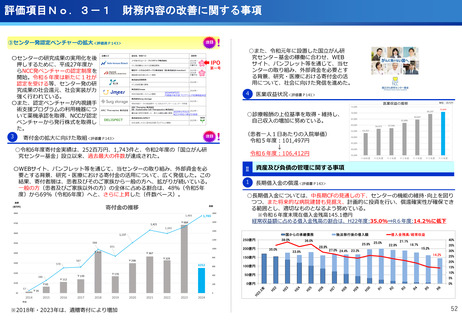
評価項目No.1-1
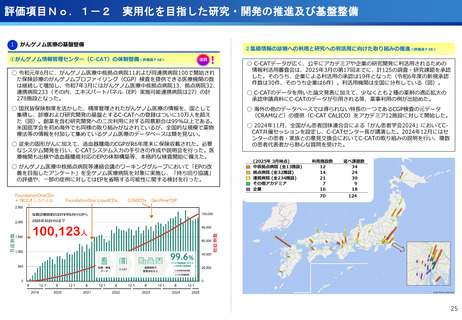
担当領域の特性を踏まえた戦略的かつ重点的な研究・開発の推進
②再発・難治性悪性脳腫瘍に対する日本初の新規放射性治療薬64Cu-ATSMの安全性・有効性を
確認<評価書P7>
③放射性抗体の超音波内視鏡ガイド投与による膵がんPET画像診断の医師主導治験(第Ⅰ相臨床試
験)を開始 <評価書P7>
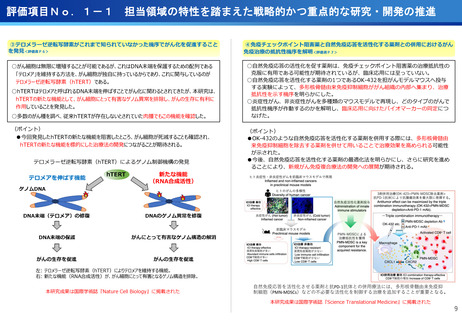
○代表的な希少がん・難治性がんである、悪性神経膠腫・中枢神経系悪性リンパ腫、
○生存延長効果が期待される1cm未満の微小膵がんの発見と精密な治療方針の決定を
実現するための新しいPET用放射性薬剤を用いた画像診断法の医師主導治験を開始
○世界で初めて本薬剤(64Cu-NCAB001)をヒトの腹腔内に投与してPET画像診断を
実施し、本診断法の安全性と推奨投与量を評価
転移性脳腫瘍などの悪性脳腫瘍の患者を対象に、日本で開発された新規放射性治療
薬64Cu-ATSMの第I相医師主導臨床試験を実施し、安全性・有効性を確認した。
○承認申請に向けて、悪性神経膠腫に対する第Ⅲ相比較試験を開始した。
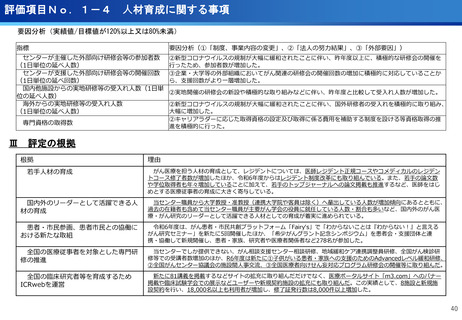
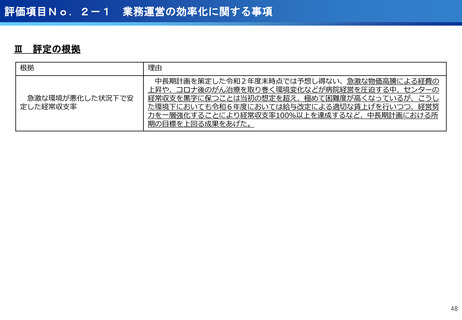
(ポイント)
●膠芽腫の患者は再発すると、一般的に1年以上生存される患者は30~40%
であり、第Ⅰ相試験の結果(55.6%)から有効な治療効果が期待される。
●第Ⅲ相医師主導治験を6月から開始、日本発の放射線治療薬としての承認を目指す。
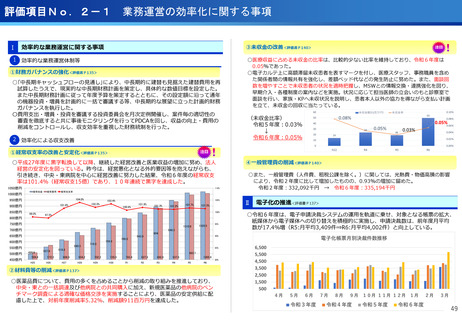
(ポイント)
●本試験で用いる新しいPET用放射性薬剤(64Cu-NCAB001)は、通常のPET画像
診断では画像化できない3mm~1cmの微小膵がんを明瞭に画像化できることが非
臨床試験で証明されている。
●通常のPET検査(FDG-PET)では、放射性フッ素を付加したブドウ糖を静脈から
注射するのに対し、本試験では膵がん細胞の表面に高発現する上皮成長因子受容
体(EGFR)に特異的に結合する特性を有する放射性抗体(64Cu-NCAB001)を
超音波内視鏡で腹腔内に投与(超音波内視鏡ガイド投与)しPET画像診断を実施。
本薬剤(64Cu-NCAB001)のヒトへの投与は世界で初めてのファースト・イン・
ヒューマン試験となる。
承認申請に向け第III相比較試験を開始
膵がんの早期診断を実現へ
11
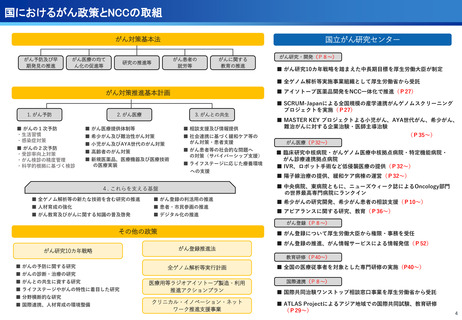
担当領域の特性を踏まえた戦略的かつ重点的な研究・開発の推進
②再発・難治性悪性脳腫瘍に対する日本初の新規放射性治療薬64Cu-ATSMの安全性・有効性を
確認<評価書P7>
③放射性抗体の超音波内視鏡ガイド投与による膵がんPET画像診断の医師主導治験(第Ⅰ相臨床試
験)を開始 <評価書P7>
○代表的な希少がん・難治性がんである、悪性神経膠腫・中枢神経系悪性リンパ腫、
○生存延長効果が期待される1cm未満の微小膵がんの発見と精密な治療方針の決定を
実現するための新しいPET用放射性薬剤を用いた画像診断法の医師主導治験を開始
○世界で初めて本薬剤(64Cu-NCAB001)をヒトの腹腔内に投与してPET画像診断を
実施し、本診断法の安全性と推奨投与量を評価
転移性脳腫瘍などの悪性脳腫瘍の患者を対象に、日本で開発された新規放射性治療
薬64Cu-ATSMの第I相医師主導臨床試験を実施し、安全性・有効性を確認した。
○承認申請に向けて、悪性神経膠腫に対する第Ⅲ相比較試験を開始した。
(ポイント)
●膠芽腫の患者は再発すると、一般的に1年以上生存される患者は30~40%
であり、第Ⅰ相試験の結果(55.6%)から有効な治療効果が期待される。
●第Ⅲ相医師主導治験を6月から開始、日本発の放射線治療薬としての承認を目指す。
(ポイント)
●本試験で用いる新しいPET用放射性薬剤(64Cu-NCAB001)は、通常のPET画像
診断では画像化できない3mm~1cmの微小膵がんを明瞭に画像化できることが非
臨床試験で証明されている。
●通常のPET検査(FDG-PET)では、放射性フッ素を付加したブドウ糖を静脈から
注射するのに対し、本試験では膵がん細胞の表面に高発現する上皮成長因子受容
体(EGFR)に特異的に結合する特性を有する放射性抗体(64Cu-NCAB001)を
超音波内視鏡で腹腔内に投与(超音波内視鏡ガイド投与)しPET画像診断を実施。
本薬剤(64Cu-NCAB001)のヒトへの投与は世界で初めてのファースト・イン・
ヒューマン試験となる。
承認申請に向け第III相比較試験を開始
膵がんの早期診断を実現へ
11