よむ、つかう、まなぶ。
資料2‐2 令和6年度 業務実績概要説明資料 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59553.html |
| 出典情報 | 厚生労働省国立研究開発法人等審議会 高度専門医療研究評価部会(第40回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
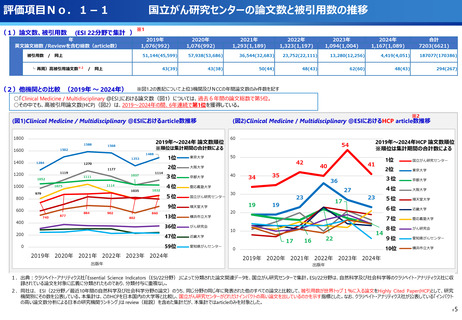
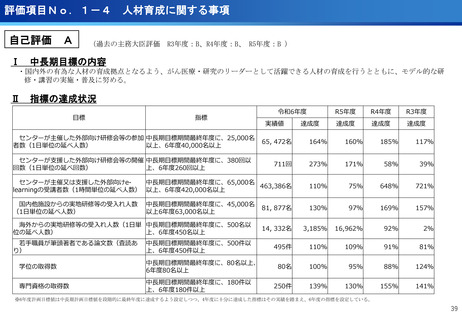
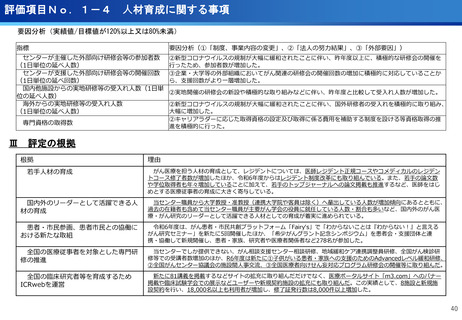
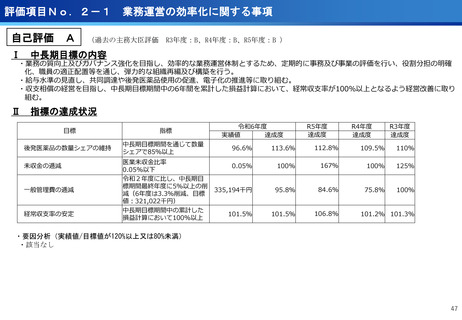
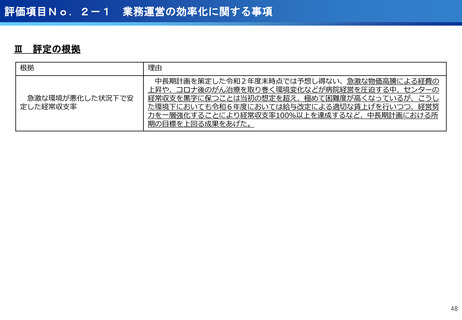
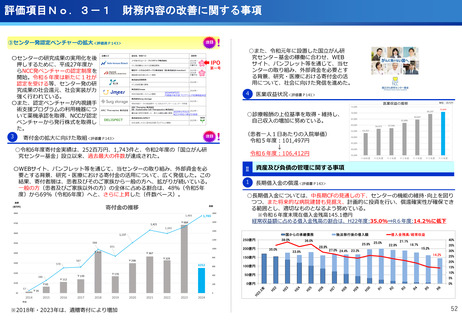
評価項目No.1-1
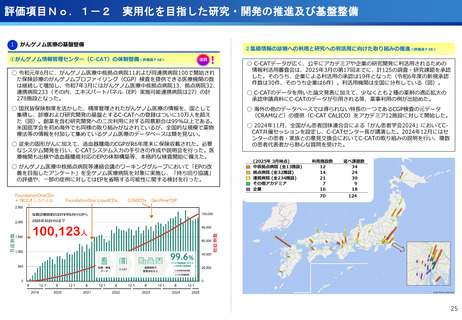
担当領域の特性を踏まえた戦略的かつ重点的な研究・開発の推進
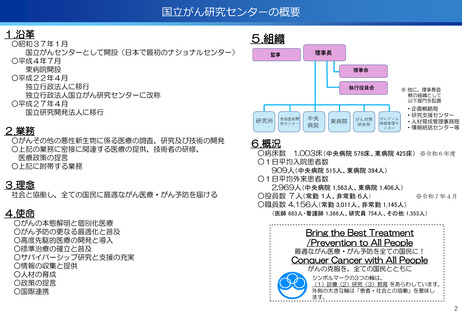
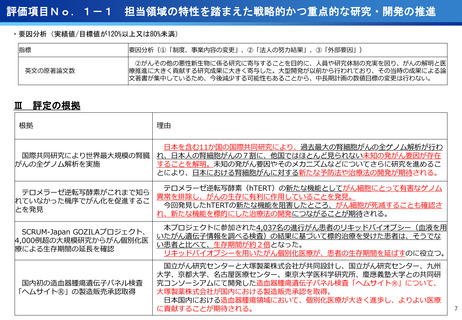
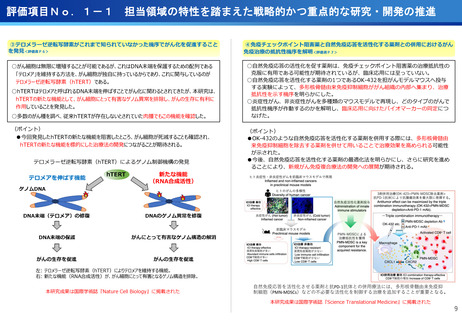
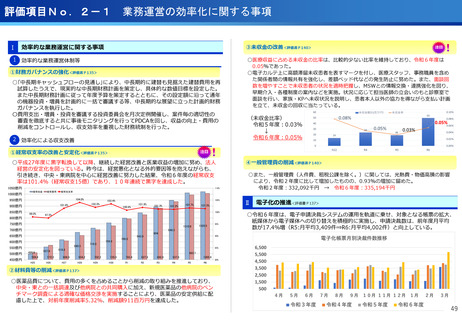
③再生細胞医薬品国内開発エコモデル<評価書P7>
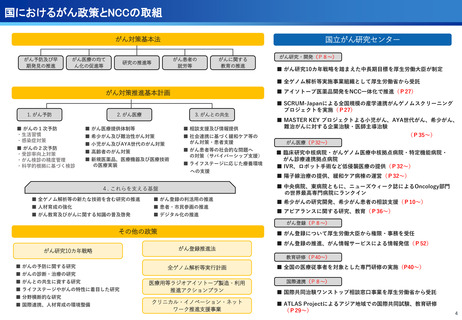
④国際標準化を⽬指すRLT
○再生医療特に、細胞治療は、多くのアカデミアを中心とする国内研究者が高い技術
やシーズ候補を持っているが実用化のための臨床試験実施が進んでいない。
○東病院を中心にアカデミア再生細胞は、すでに複数の試験を実施し育成したベン
チャーは海外での試験を実施するに至っている。
○国内外の再生医療 特に細胞治療医薬品創薬を加速するために国内外の企業が集約
しエコプラットホームを構築して稼働している。
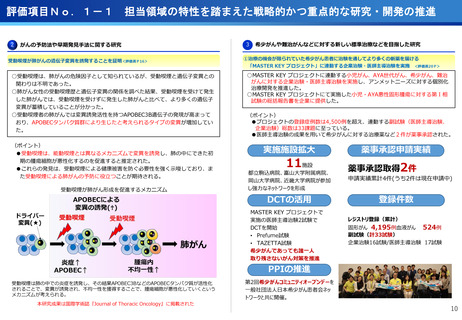
○放射線医薬品開発におけるネックであるヒトへの少量投与(フェーズ0)について、
欧米のIND試験との規制の差により開発のボトルネックが存在。
○特定臨床研究の枠組みを利用し、医師主導臨床研究で治験クオリティで実施。
○結果をもとに日米共同治験を企業が治験を開始することで開発が加速。
(ポイント)
●新しいがん治療における技術である再生細胞医薬品の開発のエコモデルが構築。
●医師主導治験のデータをもとに海外での臨床試験計画や資金獲得が可能となりド
ラッグラグ・ロスへの対策となる。
●海外からのベンチャーシーズも国内で治験実施まで可能な体制が構築できている。
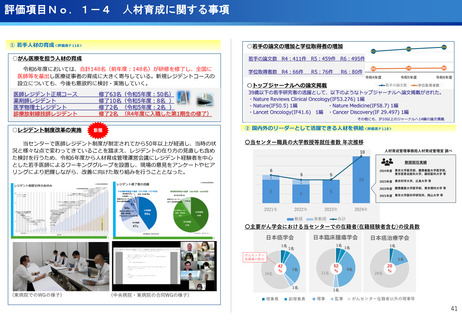
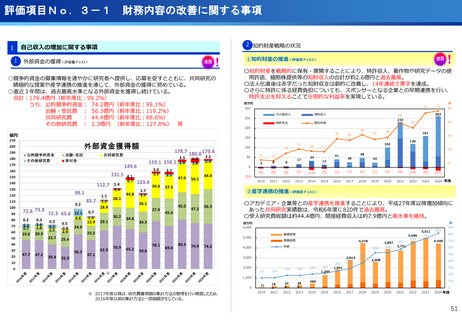
フェーズ0臨床試験実施<評価書P25>
(ポイント)
●放射線医薬品開発におけるボトルネックを克服することで国際共同試験参画が可
能になる。
●日本におけるセラノスティクスのフェーズゼロが実施可能となりより精度の高い
プレシジョンが可能になる。
●動物実験の規制に先んじて臨床試験体制を構築。
●ペプチドリーム社との共同実施で日本のアイソトープ医薬事業を加速。
海外展開(米国・豪州・韓国)で資金調達
日本で治験実施可能になっている
今年度、さらにA-SEEDS の試験を開始
ヒトと動物モデルの集積の違い(左)及びヒトにおける非特異的に消化管に流れていくことがわ
かるため毒性が予測される
米国CDMO セラリス社も参入
13
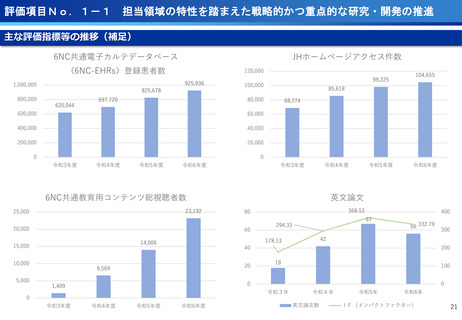
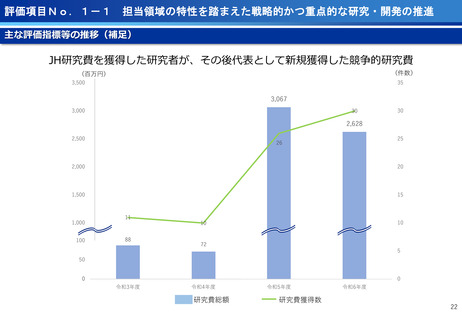
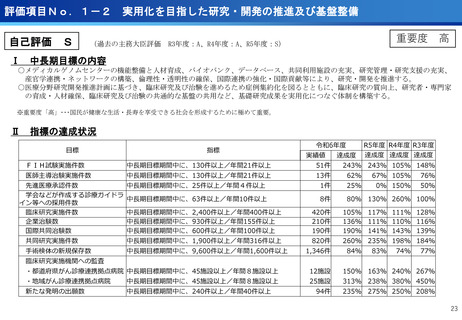
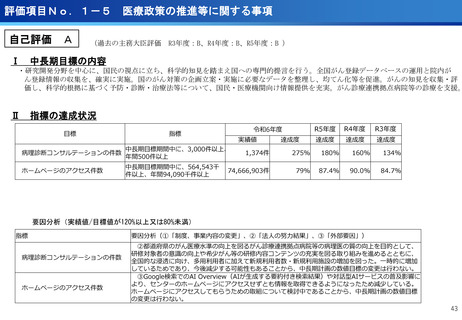
担当領域の特性を踏まえた戦略的かつ重点的な研究・開発の推進
③再生細胞医薬品国内開発エコモデル<評価書P7>
④国際標準化を⽬指すRLT
○再生医療特に、細胞治療は、多くのアカデミアを中心とする国内研究者が高い技術
やシーズ候補を持っているが実用化のための臨床試験実施が進んでいない。
○東病院を中心にアカデミア再生細胞は、すでに複数の試験を実施し育成したベン
チャーは海外での試験を実施するに至っている。
○国内外の再生医療 特に細胞治療医薬品創薬を加速するために国内外の企業が集約
しエコプラットホームを構築して稼働している。
○放射線医薬品開発におけるネックであるヒトへの少量投与(フェーズ0)について、
欧米のIND試験との規制の差により開発のボトルネックが存在。
○特定臨床研究の枠組みを利用し、医師主導臨床研究で治験クオリティで実施。
○結果をもとに日米共同治験を企業が治験を開始することで開発が加速。
(ポイント)
●新しいがん治療における技術である再生細胞医薬品の開発のエコモデルが構築。
●医師主導治験のデータをもとに海外での臨床試験計画や資金獲得が可能となりド
ラッグラグ・ロスへの対策となる。
●海外からのベンチャーシーズも国内で治験実施まで可能な体制が構築できている。
フェーズ0臨床試験実施<評価書P25>
(ポイント)
●放射線医薬品開発におけるボトルネックを克服することで国際共同試験参画が可
能になる。
●日本におけるセラノスティクスのフェーズゼロが実施可能となりより精度の高い
プレシジョンが可能になる。
●動物実験の規制に先んじて臨床試験体制を構築。
●ペプチドリーム社との共同実施で日本のアイソトープ医薬事業を加速。
海外展開(米国・豪州・韓国)で資金調達
日本で治験実施可能になっている
今年度、さらにA-SEEDS の試験を開始
ヒトと動物モデルの集積の違い(左)及びヒトにおける非特異的に消化管に流れていくことがわ
かるため毒性が予測される
米国CDMO セラリス社も参入
13