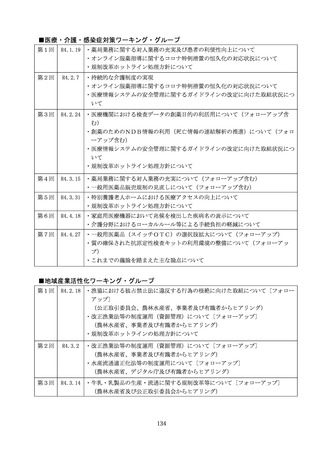
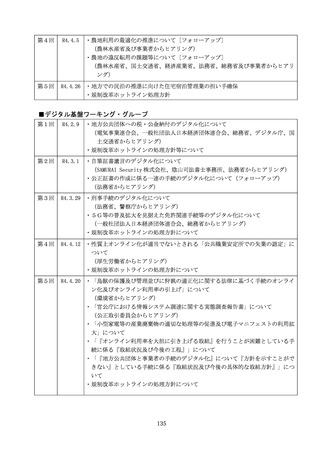
規制改革推進に関する答申(案) (68 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/committee/220527/agenda.html |
| 出典情報 | 規制改革推進会議(第13回 5/27)《内閣府》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(令和3年
12 月 24 日閣議決定)等を踏まえ、申請等手続を書面で行う場合の医師又は患
者の当該書面への押印又は署名、当該書面の日本産業規格A列4番以外の大き
さ又は白以外の色による作成等によって医療機関等に生じる負担を軽減する
ため、医療現場、地方公共団体その他の関係者の意見を踏まえて相当の業務量
が生じていると認められる申請等手続についてデジタル化(電子メールにより
申請等手続を行うことを含む。)を進めるための工程表を作成する。当該工程
表には、申請等手続のデジタル化のみならず、書面による作成を求める場合の
医療機関等の負担軽減に関する方策を含むものとし、署名又は押印の廃止や、
その廃止を困難とする場合に署名又は押印を印刷印影又は組織印に代えるこ
との可否に関する内容を含むものとする。
b 厚生労働省は、電子処方箋以外の医療現場での書類について、デジタル化によ
って、医療従事者の負担軽減等を実現する観点から、電子署名の要否等につい
て整理を行う。
(4)質の高い医療を支える先端的な医薬品・医療機器の開発の促進
<基本的考え方>
地方の高齢者などを含め、全国どこに住んでいても高度な医療を受けることを
可能にするため、SaMDに関する審査の在り方を見直すこと等を通じて、諸外
国と遜色のない程度に、社会実装を進めることが重要である。また、我が国の創
薬力を強化する観点から、創薬に必要なデータ基盤の整備や利活用、被験者の来
院・入院に依存しない在宅での治験であるDCT(Decentralized Clinical
Trials:分散化臨床試験)を円滑に行うための環境整備を進める必要がある。
以上の基本的考え方に基づき、以下の措置を講ずるべきである。
<実施事項>
ア プログラム医療機器(SaMD)に関する承認審査等の見直し
【a:令和4年度措置、b:令和4年度結論、
c:引き続き検討を進め、令和4年度措置、その後継続的に措置、
d:引き続き検討を進め、早期に結論】
a 厚生労働省は、画像診断用途のSaMDについて、当該SaMDが実使用さ
れる臨床現場で現に行われている診断技術の水準を踏まえ、それらとの比較に
おける有用性が審査上重要であることを明確にする。
b 厚生労働省は、SaMDの承認後の追加学習を通じた有効性向上のためのア
ップデートなど一定範囲のアップデートについて、SaMDの上市後の機能向
上が欧米諸国と同程度に確保され、臨床現場に恩恵をもたらすことを目指し、
国際整合を踏まえつつ、アップデート後の有効性の状況をPMDAがあらかじ
め開発事業者に確認できることなど一定の条件の下で、PMDAによる審査省
略を含め審査の簡略化を検討する。 ※
63