よむ、つかう、まなぶ。
05資料2-1森野委員提出資料(RSウイルス母子免疫ワクチンと抗体製剤ファクトシート) (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
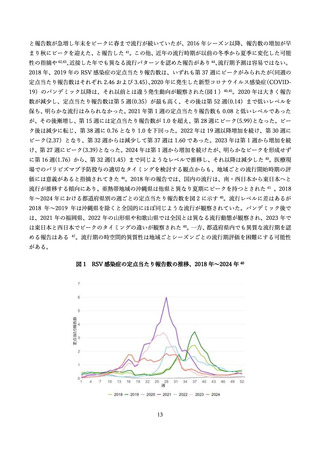
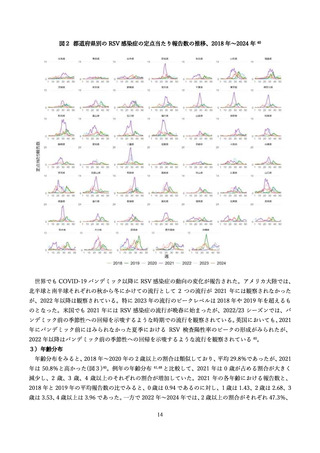
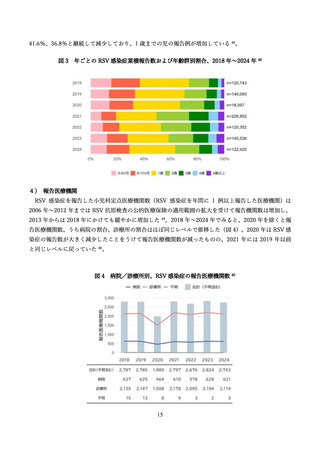
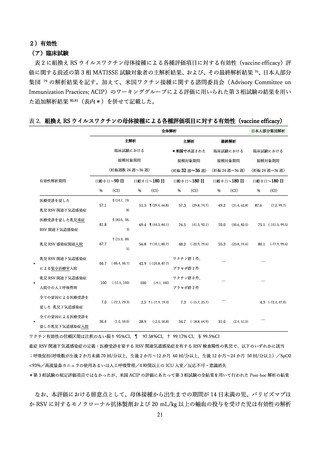
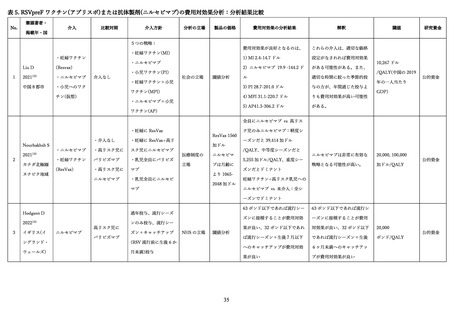
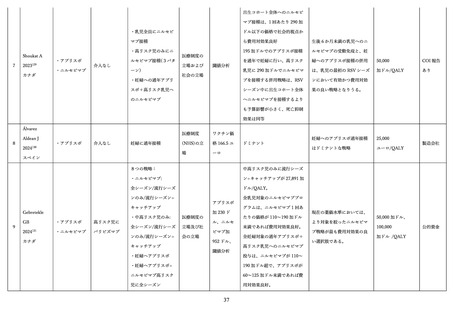
抗体の量を最大化し、胎児を最大限保護する観点から、妊娠間隔によらず妊娠ごとに 28 週以降でアブリ
スボ®を接種することを推奨している 114。なお、健康成人を対象とした第 1/2 相試験において再接種の安
全性についても評価が行われており、再接種は初回接種と同様に忍容性が良好であった 74。
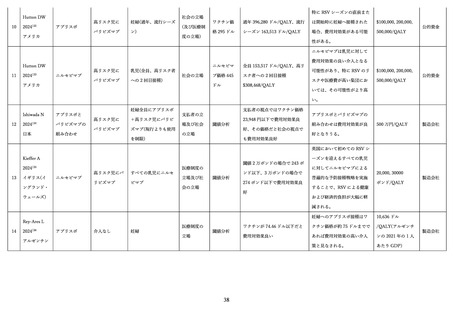
② 抗体製剤の安全性
1)概要
ニルセビマブの局所の副反応として、発赤や紫斑の出現や発熱、全身の副反応として、アナフィラキシ
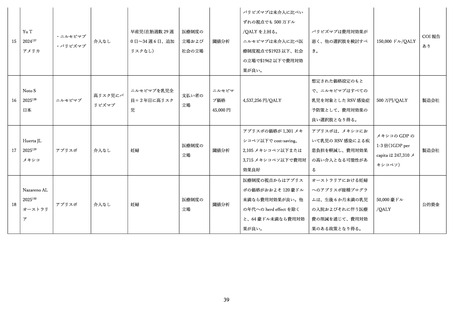
ーを含む過敏反応、血管炎、心内膜炎、神経炎、糸球体腎炎、血清病、関節炎を含む免疫複合疾患、血小
板減少が起こりうるが、一般的に安全で忍容性の高い製剤であることが報告されている。下痢や腸炎の報
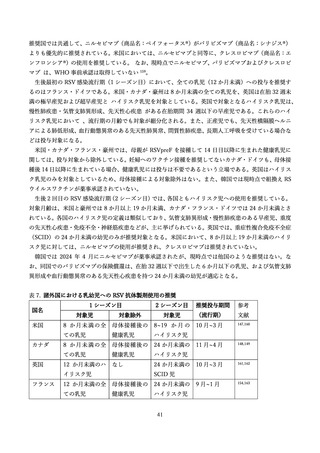
告もある 87,115。ニルゼビマブの禁忌としては、以前のニルセビマブの投与でアナフィラキシーを起こし
た場合である。小児の他のルーチンワクチンとは干渉しないと考えられ 116、データは限られているが、
ルーチンワクチンとの同時接種において副反応の発生頻度の差も報告されていない 117。このため米国
CDC は、現在のベストプラクティスに従い、小児のルーチンワクチンとの同時接種を推奨している 118。
2)特定の集団における安全性
(ア)後期早産児および正期産児に対する安全性
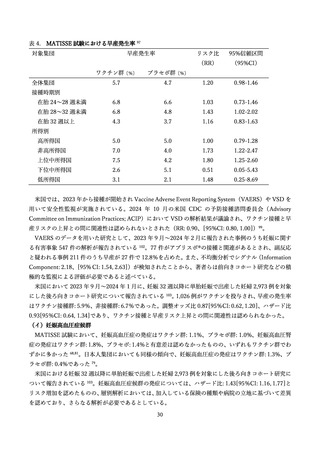
35 週以上の後期早産児および正期産児を対象とした臨床試験において、Grade3 以上の副反応がニル
セビマブ投与群において 3.6%、プラセボ群において 4.3%報告された。接種後 1 日以内の副反応は 1.8%
と 0.6%と少なくすべて両親や介護者によって回復する範囲であった。7 日以内の接種部位の疼痛、発赤、
不快感および発熱はニルセビマブ投与群において 0.6%、プラセボ群で 0.4%認められた。死亡 3 例が認
められたが、ニルセビマブ投与との関連は認めなかった 73。
(イ)早産児(慢性肺疾患を伴わない)に対する安全性
29 週~34 週の健康な早産児で1歳以下の 1,453 例を対象に、初回の RSV シーズンの間に南北半球を
含む 23 か国で実施された臨床試験(無作為割付 2:1)において、ニルセビマブ接種(50 ㎎<5 ㎏ of
body weight、100 ㎎ for ≥5 ㎏ of body weight)後 361 日フォローアップされた。ニルセビマブ接種群
の 11%プラセボ群の 16%で副反応が認められたがどれもニルセビマブ投与との関連は認められなかった
。またほとんどが Grade1 または Grade2 の副反応であった 87 。
87
血小板減少、免疫複合疾患はニルセビマブ投与群で 0.5%、プラセボ群で 0.6%に認められたが、アナ
フィラキシーショックを含む過敏反応は認められなかった。また両群での副反応の発生に差は見られな
かった。接種と関連すると考えられた副反応は、接種群の発赤 4 例と紫斑1例およびプラセボ群の発赤 3
例であった。発熱は接種群で 11.5%、プラセボ群で 13.4%に認められた 87。ニルセビマブ投与と関連す
ると考えられる死亡はなかった。
(ウ)先天性心疾患を有する児または慢性肺疾患を有する児に対する安全性
35 週未満の早期産児と、先天性心疾患あるいは慢性肺疾患を有する児を対象にパリビズマブをコント
ロール群としてニルセビマブ投与を実施した第 2/3 相試験において、心疾患・慢性肺疾患の児と早産児
の間で副反応の発生頻度に差はみられなかった。心疾患・慢性肺疾患を有する児において、抗体製剤に関
連すると思われる重症副反応は認められなかった。なおこの臨床試験は、早産児や先天性疾患の医療ケア
が充実した国において実施された試験である 119。
また 2 回目の RSV シーズンにおけるニルゼビマブの投与において、パリビズマブを毎月 5 回投与した
32
スボ®を接種することを推奨している 114。なお、健康成人を対象とした第 1/2 相試験において再接種の安
全性についても評価が行われており、再接種は初回接種と同様に忍容性が良好であった 74。
② 抗体製剤の安全性
1)概要
ニルセビマブの局所の副反応として、発赤や紫斑の出現や発熱、全身の副反応として、アナフィラキシ
ーを含む過敏反応、血管炎、心内膜炎、神経炎、糸球体腎炎、血清病、関節炎を含む免疫複合疾患、血小
板減少が起こりうるが、一般的に安全で忍容性の高い製剤であることが報告されている。下痢や腸炎の報
告もある 87,115。ニルゼビマブの禁忌としては、以前のニルセビマブの投与でアナフィラキシーを起こし
た場合である。小児の他のルーチンワクチンとは干渉しないと考えられ 116、データは限られているが、
ルーチンワクチンとの同時接種において副反応の発生頻度の差も報告されていない 117。このため米国
CDC は、現在のベストプラクティスに従い、小児のルーチンワクチンとの同時接種を推奨している 118。
2)特定の集団における安全性
(ア)後期早産児および正期産児に対する安全性
35 週以上の後期早産児および正期産児を対象とした臨床試験において、Grade3 以上の副反応がニル
セビマブ投与群において 3.6%、プラセボ群において 4.3%報告された。接種後 1 日以内の副反応は 1.8%
と 0.6%と少なくすべて両親や介護者によって回復する範囲であった。7 日以内の接種部位の疼痛、発赤、
不快感および発熱はニルセビマブ投与群において 0.6%、プラセボ群で 0.4%認められた。死亡 3 例が認
められたが、ニルセビマブ投与との関連は認めなかった 73。
(イ)早産児(慢性肺疾患を伴わない)に対する安全性
29 週~34 週の健康な早産児で1歳以下の 1,453 例を対象に、初回の RSV シーズンの間に南北半球を
含む 23 か国で実施された臨床試験(無作為割付 2:1)において、ニルセビマブ接種(50 ㎎<5 ㎏ of
body weight、100 ㎎ for ≥5 ㎏ of body weight)後 361 日フォローアップされた。ニルセビマブ接種群
の 11%プラセボ群の 16%で副反応が認められたがどれもニルセビマブ投与との関連は認められなかった
。またほとんどが Grade1 または Grade2 の副反応であった 87 。
87
血小板減少、免疫複合疾患はニルセビマブ投与群で 0.5%、プラセボ群で 0.6%に認められたが、アナ
フィラキシーショックを含む過敏反応は認められなかった。また両群での副反応の発生に差は見られな
かった。接種と関連すると考えられた副反応は、接種群の発赤 4 例と紫斑1例およびプラセボ群の発赤 3
例であった。発熱は接種群で 11.5%、プラセボ群で 13.4%に認められた 87。ニルセビマブ投与と関連す
ると考えられる死亡はなかった。
(ウ)先天性心疾患を有する児または慢性肺疾患を有する児に対する安全性
35 週未満の早期産児と、先天性心疾患あるいは慢性肺疾患を有する児を対象にパリビズマブをコント
ロール群としてニルセビマブ投与を実施した第 2/3 相試験において、心疾患・慢性肺疾患の児と早産児
の間で副反応の発生頻度に差はみられなかった。心疾患・慢性肺疾患を有する児において、抗体製剤に関
連すると思われる重症副反応は認められなかった。なおこの臨床試験は、早産児や先天性疾患の医療ケア
が充実した国において実施された試験である 119。
また 2 回目の RSV シーズンにおけるニルゼビマブの投与において、パリビズマブを毎月 5 回投与した
32