よむ、つかう、まなぶ。
05資料2-1森野委員提出資料(RSウイルス母子免疫ワクチンと抗体製剤ファクトシート) (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
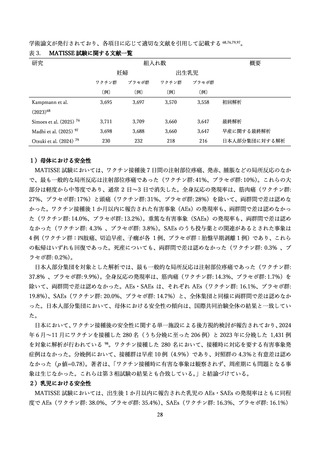
(ウ)ワクチン関連増強呼吸器疾患(VAERD)
1960 年代にホルマリン不活化 RSV ワクチン(FI-RSV)が開発されたが、ワクチン接種児が RSV に自
然感染した際に、非接種児よりも重篤な呼吸器疾患(VAERD)を引き起こす事象が報告された 104,105。こ
れは、中和活性の低い IgG 抗体が誘導され、RS ウイルスに対して十分な免疫応答が惹起されなかった
こと、T 細胞応答が不十分で不均衡であったことなどから、炎症反応が誘起されたことによるものと考え
られている 106。アブリスボ®は、安定化された膜融合前型 F タンパク質を抗原として用いることで、高レ
ベルの中和抗体を誘導し、VAERD のリスクを回避するように設計されている 74。これまでのところ、
VAERD を示唆するエビデンスは報告されていない。
(エ)ギラン・バレ症候群(GBS)およびその他の脱髄疾患
臨床試験においては、妊婦における GBS 症例は報告されていない 107。一方で、アブリスボの高齢者を
対象とした臨床試験ではリスクの上昇が示唆され、接種後 42 日以内に GBS またはその亜型(ミラー・
フィッシャー症候群)を発症した症例が 2 例報告されている 108 109。
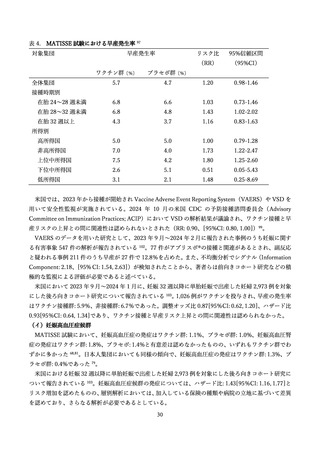
FDA が実施した米国の公的医療保険制度の一つであるメディケアのデータを用いた観察研究では、ア
ブリスボの接種後 42 日間の GBS リスク増加が示唆された(RR: 4.48、[95% CI: 0.88, 22.90])110,111。こ
れらのエビデンスを総合的に評価し、FDA は 2025 年 1 月にアブリスボの添付文書に GBS のリスクに関
する警告を追記するよう指示した 109。ただし、FDA は、現時点でのエビデンスはリスク増加を示唆する
ものの、因果関係を確立するには不十分であるとしている。引き続き慎重な監視が行われており、今後の
調査結果が待たれる。
4)特定の集団における安全性
(ア)ハイリスク群(免疫不全者、HIV 感染者、基礎疾患等を有する者等)
臨床試験においては、重度の免疫不全を有する妊婦や基礎疾患を有する妊婦は除外されており、これら
の特定の集団におけるワクチンの安全性と有効性に関するエビデンスは限られている。現在、HIV 感染
者や血液腫瘍患者などの医学的に免疫不全である患者、臓器移植後等により免疫抑制治療を受けている
患者、高血圧や糖尿病の既往がある妊婦に対する調査研究が進められており、結果が待たれる 112。
(イ)ワクチン接種後の抗体製剤接種(ニルセビマブ®との併用)
健常な乳児の RSV 感染症の予防として、母体へのアブリスボの接種以外に、乳児への長時間作用型モ
ノクローナル抗体製剤(ニルセビマブ®)投与も推奨されている 107。ほとんどの乳児においては、両方の
介入は不要であるとされているものの、例えば、母体へワクチン接種後 14 日以内に出生した場合など、
投与を検討する必要がある。ニルセビマブ®は、他の不活化ワクチンや生ワクチンの免疫応答を妨げない
と考えられており、同時接種も許容されている 113。しかし、母体がワクチン接種を受けた乳児にニルセ
ビマブ®を投与した場合の知見は、十分に明らかでなく、現在、臨床試験が進められている 81,107。
(ウ)次回妊娠時の再接種
米国 CDC は、現時点では関連するデータが不足しているため、過去の妊娠で母体 RSV ワクチンを接
種したことがある女性に対して、次回妊娠時の再接種を推奨していない 107。ACIP の議論においては、現
時点ではワクチンに潜在的な安全性懸念(早産や妊娠高血圧症候群などのリスク)が存在すること、ま
た、後続の妊娠で生まれる乳児に対しては、ニルセビマブという代替手段が存在することなどを踏まえ、
再接種の推奨にはさらなるデータの蓄積が必要としている。一方で、英国においては、胎盤を通じた移行
31
1960 年代にホルマリン不活化 RSV ワクチン(FI-RSV)が開発されたが、ワクチン接種児が RSV に自
然感染した際に、非接種児よりも重篤な呼吸器疾患(VAERD)を引き起こす事象が報告された 104,105。こ
れは、中和活性の低い IgG 抗体が誘導され、RS ウイルスに対して十分な免疫応答が惹起されなかった
こと、T 細胞応答が不十分で不均衡であったことなどから、炎症反応が誘起されたことによるものと考え
られている 106。アブリスボ®は、安定化された膜融合前型 F タンパク質を抗原として用いることで、高レ
ベルの中和抗体を誘導し、VAERD のリスクを回避するように設計されている 74。これまでのところ、
VAERD を示唆するエビデンスは報告されていない。
(エ)ギラン・バレ症候群(GBS)およびその他の脱髄疾患
臨床試験においては、妊婦における GBS 症例は報告されていない 107。一方で、アブリスボの高齢者を
対象とした臨床試験ではリスクの上昇が示唆され、接種後 42 日以内に GBS またはその亜型(ミラー・
フィッシャー症候群)を発症した症例が 2 例報告されている 108 109。
FDA が実施した米国の公的医療保険制度の一つであるメディケアのデータを用いた観察研究では、ア
ブリスボの接種後 42 日間の GBS リスク増加が示唆された(RR: 4.48、[95% CI: 0.88, 22.90])110,111。こ
れらのエビデンスを総合的に評価し、FDA は 2025 年 1 月にアブリスボの添付文書に GBS のリスクに関
する警告を追記するよう指示した 109。ただし、FDA は、現時点でのエビデンスはリスク増加を示唆する
ものの、因果関係を確立するには不十分であるとしている。引き続き慎重な監視が行われており、今後の
調査結果が待たれる。
4)特定の集団における安全性
(ア)ハイリスク群(免疫不全者、HIV 感染者、基礎疾患等を有する者等)
臨床試験においては、重度の免疫不全を有する妊婦や基礎疾患を有する妊婦は除外されており、これら
の特定の集団におけるワクチンの安全性と有効性に関するエビデンスは限られている。現在、HIV 感染
者や血液腫瘍患者などの医学的に免疫不全である患者、臓器移植後等により免疫抑制治療を受けている
患者、高血圧や糖尿病の既往がある妊婦に対する調査研究が進められており、結果が待たれる 112。
(イ)ワクチン接種後の抗体製剤接種(ニルセビマブ®との併用)
健常な乳児の RSV 感染症の予防として、母体へのアブリスボの接種以外に、乳児への長時間作用型モ
ノクローナル抗体製剤(ニルセビマブ®)投与も推奨されている 107。ほとんどの乳児においては、両方の
介入は不要であるとされているものの、例えば、母体へワクチン接種後 14 日以内に出生した場合など、
投与を検討する必要がある。ニルセビマブ®は、他の不活化ワクチンや生ワクチンの免疫応答を妨げない
と考えられており、同時接種も許容されている 113。しかし、母体がワクチン接種を受けた乳児にニルセ
ビマブ®を投与した場合の知見は、十分に明らかでなく、現在、臨床試験が進められている 81,107。
(ウ)次回妊娠時の再接種
米国 CDC は、現時点では関連するデータが不足しているため、過去の妊娠で母体 RSV ワクチンを接
種したことがある女性に対して、次回妊娠時の再接種を推奨していない 107。ACIP の議論においては、現
時点ではワクチンに潜在的な安全性懸念(早産や妊娠高血圧症候群などのリスク)が存在すること、ま
た、後続の妊娠で生まれる乳児に対しては、ニルセビマブという代替手段が存在することなどを踏まえ、
再接種の推奨にはさらなるデータの蓄積が必要としている。一方で、英国においては、胎盤を通じた移行
31