よむ、つかう、まなぶ。
05資料2-1森野委員提出資料(RSウイルス母子免疫ワクチンと抗体製剤ファクトシート) (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
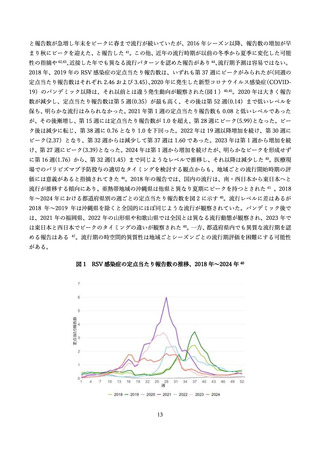
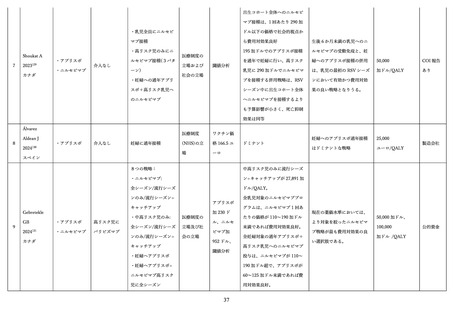
であった。
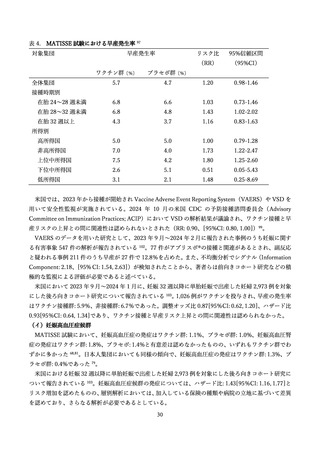
生後 24 か月までの追跡期間において、
乳児における新たな安全性の懸念は特定されなかった。
死亡例については、ワクチン群: 8 例、プラセボ群: 14 例であったが、いずれも母体へのワクチン接種と
の因果関係は否定された。Small for gestational age(SGA)はワクチン群: 6.9%・プラセボ群: 6.4%、低
出生体重(2,500g 以下)はワクチン群: 5.1%・プラセボ群: 4.3%、先天異常はワクチン群: 5.6%・プラセ
ボ群: 6.7%、発育遅延はワクチン群: 0.7%・プラセボ群: 0.5%、と両群間で差は認めなった。
日本人部分集団を対象とした解析では、AEs(ワクチン群: 48.6%、プラセボ群: 50.5%)
、SAEs(ワク
チン群: 31.2%、プラセボ群:31.9%)と、全体集団と同様に両群間で差は認めなかったが、発生率はとも
に高い傾向を示した。低出生体重(2,500g 以下)はワクチン群: 6.9%・プラセボ群: 9.7%と、全体集団と
同様に両群間で差は認めなかった。
米国の Vaccine Safety Datalink (VSD)による解析も行われており、SGA とワクチン接種との関連は認
められなかった(リスク比: 1.03、95%信頼区間(CI): 0.94, 1.14)99。
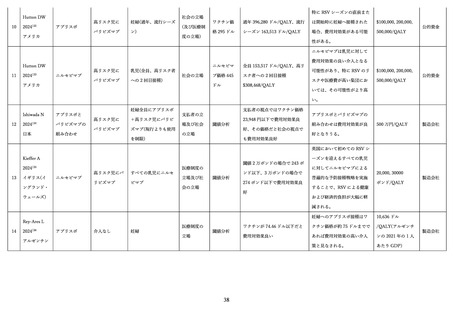
3)そのほかの有害事象
RS ウイルスワクチンについては、特に注目すべき有害事象(AESI)として早産や低出生体重児などが
ある。また、開発経緯等を踏まえ、ワクチン関連増強呼吸器疾患(VAERD)にも注意を払う必要がある。
本項では1)
、2)で触れた事象以外の有害事象について述べる。
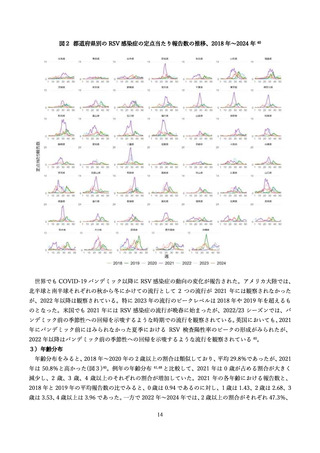
(ア) 早産
MATISSE 試験において、早産発生率が、統計学的に有意ではないものの、ワクチン群: 5.7%、プラセ
ボ: 4.7%(RR: 1.20、[95% CI: 0.98, 1.46])と数値的不均衡を認め、ワクチン接種時期や試験の実施国に
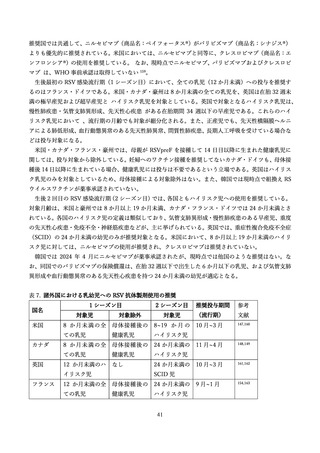
おける所得等別の部分解析においても不均衡を認めた(表2)97。なかでも、南アフリカではワクチン群:
8.3%、プラセボ群: 4.0%(RR: 2.06、[95%CI: 1.21, 3.51])と、有意差を認めた 100。一方、日本人部分集
団においては、ワクチン群で発生率が低かった(ワクチン: 3.0%、プラセボ群: 5.6%、RR: 0.54、[95% CI:
0.22, 1.33])
。米国食品医薬品局(FDA)は、32 週からの接種開始は早産および早産による合併症の潜在
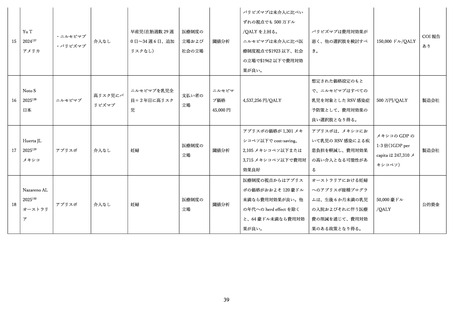
的リスクを低減できる観点から、接種期間を 32 週~36 週に限定して承認するとともに、注意喚起を行っ
た 81。一方、欧州医薬品庁と独立行政法人医薬品医療機器総合機構は、24 週~36 週での接種を承認した
ものの、市販後の監視を求めている 77,101。欧州医薬品庁(EMA)は、ワクチン接種群のうち、高中所得国
グループの妊婦において、早産がわずかに増加したものの、この差は統計的な有意差を認めず、早産の絶
対数の増加はわずかであり、その結果として新生児の有害な転帰の増加にはつながらなかったとしてい
る 101。また、独立行政法人医薬品医療機器総合機構(PMDA)は、本剤の接種が可能な妊娠週数を臨床
試験 で組み入れられた範囲からさらに限定する又はその範囲の一部を推奨する根拠とすべきデータは
現時点では得られていないこと、本剤の製造販売後には様々な健康状態や妊娠経過を有する妊婦への接
種が想定され、接種可能な期間を長く設定し医師及び被接種者が最適な接種時期を決定できるようにす
ることは意義があるとしている 77。
29
生後 24 か月までの追跡期間において、
乳児における新たな安全性の懸念は特定されなかった。
死亡例については、ワクチン群: 8 例、プラセボ群: 14 例であったが、いずれも母体へのワクチン接種と
の因果関係は否定された。Small for gestational age(SGA)はワクチン群: 6.9%・プラセボ群: 6.4%、低
出生体重(2,500g 以下)はワクチン群: 5.1%・プラセボ群: 4.3%、先天異常はワクチン群: 5.6%・プラセ
ボ群: 6.7%、発育遅延はワクチン群: 0.7%・プラセボ群: 0.5%、と両群間で差は認めなった。
日本人部分集団を対象とした解析では、AEs(ワクチン群: 48.6%、プラセボ群: 50.5%)
、SAEs(ワク
チン群: 31.2%、プラセボ群:31.9%)と、全体集団と同様に両群間で差は認めなかったが、発生率はとも
に高い傾向を示した。低出生体重(2,500g 以下)はワクチン群: 6.9%・プラセボ群: 9.7%と、全体集団と
同様に両群間で差は認めなかった。
米国の Vaccine Safety Datalink (VSD)による解析も行われており、SGA とワクチン接種との関連は認
められなかった(リスク比: 1.03、95%信頼区間(CI): 0.94, 1.14)99。
3)そのほかの有害事象
RS ウイルスワクチンについては、特に注目すべき有害事象(AESI)として早産や低出生体重児などが
ある。また、開発経緯等を踏まえ、ワクチン関連増強呼吸器疾患(VAERD)にも注意を払う必要がある。
本項では1)
、2)で触れた事象以外の有害事象について述べる。
(ア) 早産
MATISSE 試験において、早産発生率が、統計学的に有意ではないものの、ワクチン群: 5.7%、プラセ
ボ: 4.7%(RR: 1.20、[95% CI: 0.98, 1.46])と数値的不均衡を認め、ワクチン接種時期や試験の実施国に
おける所得等別の部分解析においても不均衡を認めた(表2)97。なかでも、南アフリカではワクチン群:
8.3%、プラセボ群: 4.0%(RR: 2.06、[95%CI: 1.21, 3.51])と、有意差を認めた 100。一方、日本人部分集
団においては、ワクチン群で発生率が低かった(ワクチン: 3.0%、プラセボ群: 5.6%、RR: 0.54、[95% CI:
0.22, 1.33])
。米国食品医薬品局(FDA)は、32 週からの接種開始は早産および早産による合併症の潜在
的リスクを低減できる観点から、接種期間を 32 週~36 週に限定して承認するとともに、注意喚起を行っ
た 81。一方、欧州医薬品庁と独立行政法人医薬品医療機器総合機構は、24 週~36 週での接種を承認した
ものの、市販後の監視を求めている 77,101。欧州医薬品庁(EMA)は、ワクチン接種群のうち、高中所得国
グループの妊婦において、早産がわずかに増加したものの、この差は統計的な有意差を認めず、早産の絶
対数の増加はわずかであり、その結果として新生児の有害な転帰の増加にはつながらなかったとしてい
る 101。また、独立行政法人医薬品医療機器総合機構(PMDA)は、本剤の接種が可能な妊娠週数を臨床
試験 で組み入れられた範囲からさらに限定する又はその範囲の一部を推奨する根拠とすべきデータは
現時点では得られていないこと、本剤の製造販売後には様々な健康状態や妊娠経過を有する妊婦への接
種が想定され、接種可能な期間を長く設定し医師及び被接種者が最適な接種時期を決定できるようにす
ることは意義があるとしている 77。
29