よむ、つかう、まなぶ。
05資料2-1森野委員提出資料(RSウイルス母子免疫ワクチンと抗体製剤ファクトシート) (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
および乳児における RSV 関連 LRTD の予防に対して製造販売承認された。同年 3 月に 60 歳以上の者に
おける RSV 感染症の予防に適応が拡大されている。筋肉内に接種(1 回 0.5 mL)することで、RSV の膜
融合前構造の F タンパク質の中和エピトープの一つである site Ø に対する免疫応答が誘導され、中和抗
体が産生される。RSV の膜融合前構造の F タンパク質に対する中和抗体は RSV 感染阻害能を有する 64 65
。妊婦における本剤の接種により産生された中和抗体は移行抗体として、新生児及び乳児の RSV によ
66
る LRTD の予防に寄与する 67。製造販売承認上、妊娠 24 週~36 週に接種可能であるが、臨床試験にお
いて妊娠 28 週~36 週の間に接種した場合に有効性がより高い傾向が認められている 68。
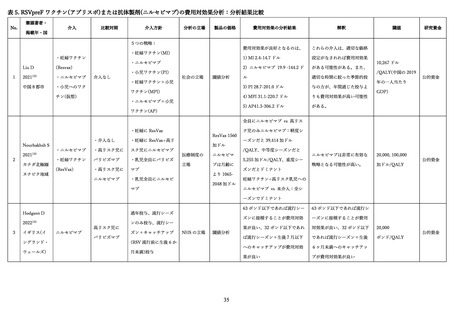
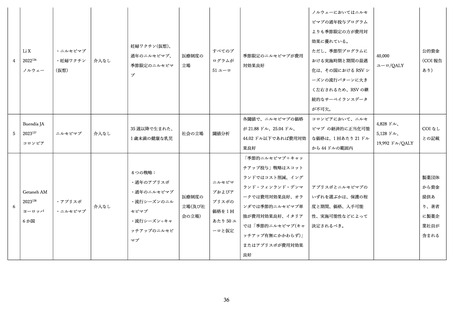
② パリビズマブ
本剤は、RSV に対するヒト化モノクローナル抗体(IgG1)であり、宿主細胞への感染時に重要な RSV
の F タンパク質上の抗原部位 A 領域に特異的に結合して RSV の感染性を中和し、
RSV 増殖が抑制され、
RSV による重篤な LRTD の発症を抑制する 69,70。日本では高リスクの新生児、乳児、幼児における RSV
感染による重篤な LRTD の発症抑制を目的として 2002 年 1 月に初めて製造販売承認された。その後、
2024 年 3 月に肺低形成等の重症化リスクの高い5疾患を伴う 24 か月齢以下の児に対して適応が追加さ
れた。体重 1 kg あたり 15 mg を月1回筋肉内投与し、RSV 感染症流行期に投与された場合のみ保険償還
の対象となる。
③
ニルセビマブ
本剤は、F タンパク質の site Ø を標的としたヒト化モノクローナル抗体(IgG1)であるが、消失半減
期の延長を目的として Fc 領域に YTE 置換(M257Y+S259T+T261E)の 3 アミノ酸置換 71 が導入され
ているため、投与頻度は 1 流行期当たり 1 回に低減されている 72 73。日本では 2024 年 3 月に、重症化リ
スクの高い児のほか、生後初回の RSV 流行期のすべての新生児及び乳幼児等を対象として製造販売承認
された。生後初回の RSV 感染流行期は、50 mg(体重 5 kg 未満)または 100 mg(体重 5 kg 以上)を 1
回、筋肉内注射する。生後 2 回目の RSV 感染流行期は、200 mg を 1 回、筋肉内注射する。生後初回又
は 2 回目の RSV 感染流行期の重篤な RSV 感染症のリスクを有する新生児、乳児及び幼児における、RSV
感染による下気道疾患の発症抑制に使用した場合に限り、保険給付される。
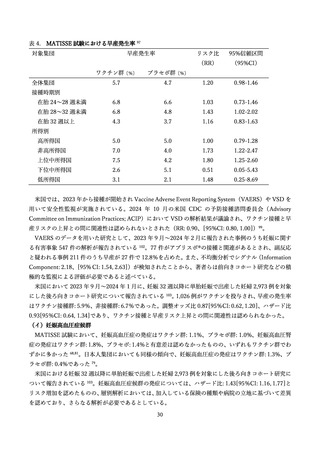
(3)有効性の観点
① 母子免疫ワクチンの免疫原性、有効性
2025 年 2 月現在国内で母子免疫ワクチンとして使用可能な RSV ワクチン製剤(ファイザー社 RSVpreF、
販売名アブリスボ®)に関する情報を以下にまとめた。
1)免疫原性
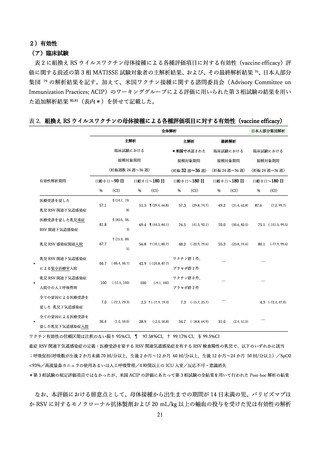
妊婦への RSVpreF 接種の免疫原性に関連する検討として、健康成人対象の海外第 1/2 相試験 74、妊婦
対象の第 2b 相試験 75 および第 3 相試験最終報告 76 の報告がある。
第 1/2 相試験は 18 歳~85 歳の健康成人対象のプラセボ対照無作為化比較試験で、そのうち 18 歳~49
歳(618 人)の結果の解析がなされた 74。組換え RS ウイルスワクチン 60 µg、120 µg または 240 µg の
3 つの用量の水酸化アルミニウム(アジュバント)含有/非含有いずれかのワクチンを接種した各群対象
者において、接種後 1 か月時点で、ハイリスク乳児において予防に寄与するとされるパリビズマブ(100
19
おける RSV 感染症の予防に適応が拡大されている。筋肉内に接種(1 回 0.5 mL)することで、RSV の膜
融合前構造の F タンパク質の中和エピトープの一つである site Ø に対する免疫応答が誘導され、中和抗
体が産生される。RSV の膜融合前構造の F タンパク質に対する中和抗体は RSV 感染阻害能を有する 64 65
。妊婦における本剤の接種により産生された中和抗体は移行抗体として、新生児及び乳児の RSV によ
66
る LRTD の予防に寄与する 67。製造販売承認上、妊娠 24 週~36 週に接種可能であるが、臨床試験にお
いて妊娠 28 週~36 週の間に接種した場合に有効性がより高い傾向が認められている 68。
② パリビズマブ
本剤は、RSV に対するヒト化モノクローナル抗体(IgG1)であり、宿主細胞への感染時に重要な RSV
の F タンパク質上の抗原部位 A 領域に特異的に結合して RSV の感染性を中和し、
RSV 増殖が抑制され、
RSV による重篤な LRTD の発症を抑制する 69,70。日本では高リスクの新生児、乳児、幼児における RSV
感染による重篤な LRTD の発症抑制を目的として 2002 年 1 月に初めて製造販売承認された。その後、
2024 年 3 月に肺低形成等の重症化リスクの高い5疾患を伴う 24 か月齢以下の児に対して適応が追加さ
れた。体重 1 kg あたり 15 mg を月1回筋肉内投与し、RSV 感染症流行期に投与された場合のみ保険償還
の対象となる。
③
ニルセビマブ
本剤は、F タンパク質の site Ø を標的としたヒト化モノクローナル抗体(IgG1)であるが、消失半減
期の延長を目的として Fc 領域に YTE 置換(M257Y+S259T+T261E)の 3 アミノ酸置換 71 が導入され
ているため、投与頻度は 1 流行期当たり 1 回に低減されている 72 73。日本では 2024 年 3 月に、重症化リ
スクの高い児のほか、生後初回の RSV 流行期のすべての新生児及び乳幼児等を対象として製造販売承認
された。生後初回の RSV 感染流行期は、50 mg(体重 5 kg 未満)または 100 mg(体重 5 kg 以上)を 1
回、筋肉内注射する。生後 2 回目の RSV 感染流行期は、200 mg を 1 回、筋肉内注射する。生後初回又
は 2 回目の RSV 感染流行期の重篤な RSV 感染症のリスクを有する新生児、乳児及び幼児における、RSV
感染による下気道疾患の発症抑制に使用した場合に限り、保険給付される。
(3)有効性の観点
① 母子免疫ワクチンの免疫原性、有効性
2025 年 2 月現在国内で母子免疫ワクチンとして使用可能な RSV ワクチン製剤(ファイザー社 RSVpreF、
販売名アブリスボ®)に関する情報を以下にまとめた。
1)免疫原性
妊婦への RSVpreF 接種の免疫原性に関連する検討として、健康成人対象の海外第 1/2 相試験 74、妊婦
対象の第 2b 相試験 75 および第 3 相試験最終報告 76 の報告がある。
第 1/2 相試験は 18 歳~85 歳の健康成人対象のプラセボ対照無作為化比較試験で、そのうち 18 歳~49
歳(618 人)の結果の解析がなされた 74。組換え RS ウイルスワクチン 60 µg、120 µg または 240 µg の
3 つの用量の水酸化アルミニウム(アジュバント)含有/非含有いずれかのワクチンを接種した各群対象
者において、接種後 1 か月時点で、ハイリスク乳児において予防に寄与するとされるパリビズマブ(100
19