よむ、つかう、まなぶ。
05資料2-1森野委員提出資料(RSウイルス母子免疫ワクチンと抗体製剤ファクトシート) (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
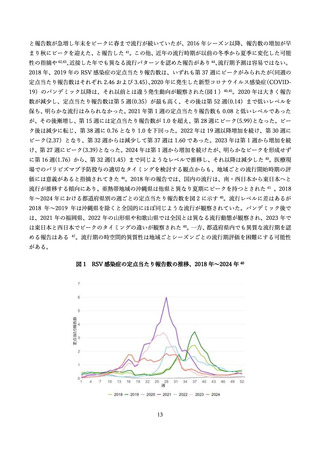
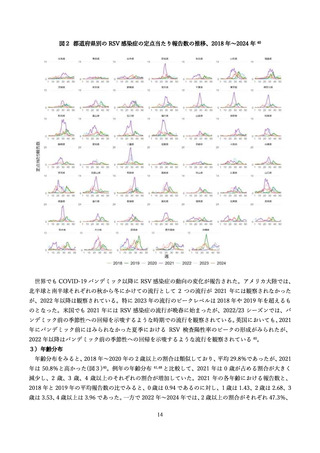
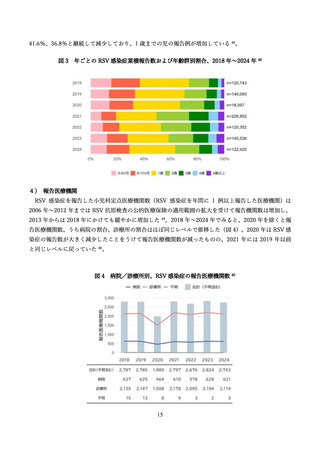
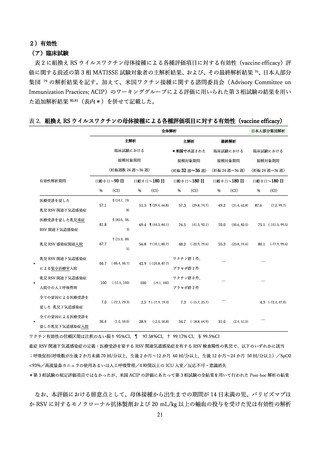
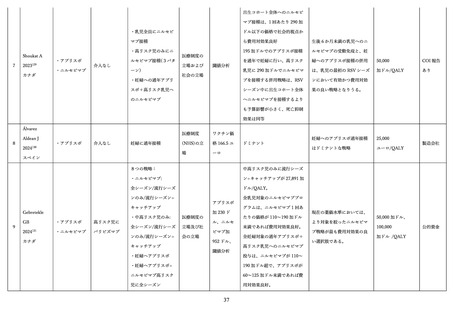
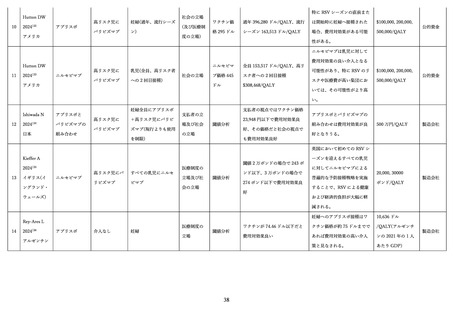
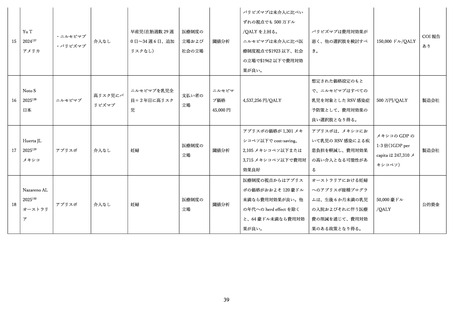
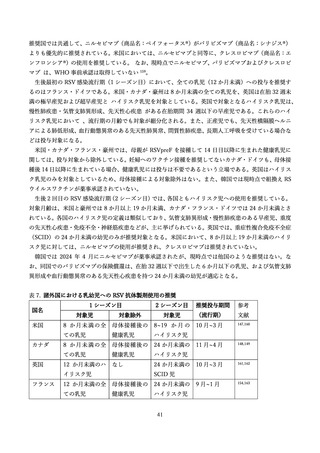
学術論文が発行されており、各項目に応じて適切な文献を引用して記載する 68,76,79,97。
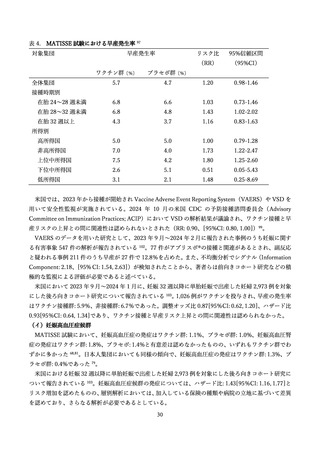
表 3.
MATISSE 試験に関する文献一覧
研究
組入れ数
概要
妊婦
出生乳児
ワクチン群
プラセボ群
ワクチン群
プラセボ群
〔例〕
〔例〕
〔例〕
〔例〕
3,695
3,697
3,570
3,558
初回解析
Simoes et al. (2025) 76
3,711
3,709
3,660
3,647
最終解析
Madhi et al. (2025) 97
3,698
3,688
3,660
3,647
早産に関する最終解析
Otsuki et al. (2024) 79
230
232
218
216
日本人部分集団に対する解析
Kampmann et al.
(2023)68
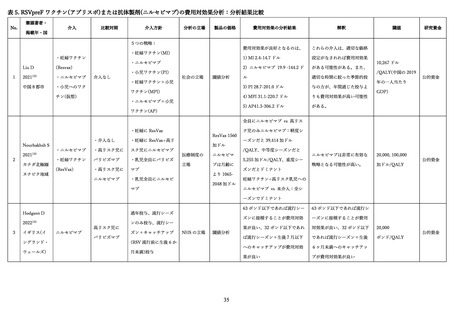
1)母体における安全性
MATISSE 試験においては、ワクチン接種後 7 日間の注射部位疼痛、発赤、腫脹などの局所反応のなか
で、最も一般的な局所反応は注射部位疼痛であった(ワクチン群: 41%、プラセボ群: 10%)
。これらの大
部分は軽度から中等度であり、通常 2 日~3 日で消失した。全身反応の発現率は、筋肉痛(ワクチン群:
27%、プラセボ群: 17%)と頭痛(ワクチン群: 31%、プラセボ群: 28%)を除いて、両群間で差は認めな
かった。ワクチン接種後 1 か月以内に報告された有害事象(AEs)の発現率も、両群間で差は認めなかっ
た(ワクチン群: 14.0%、プラセボ群: 13.2%)
。重篤な有害事象(SAEs)の発現率も、両群間で差は認め
なかった(ワクチン群: 4.3% 、プラセボ群: 3.8%)
。SAEs のうち投与薬との関連があるとされた事象は
4 例(ワクチン群:四肢痛、切迫早産、子癇が各 1 例、プラセボ群:胎盤早期剥離 1 例)であり、これら
の転帰はいずれも回復であった。死産についても、両群間で差は認めなかった(ワクチン群: 0.3% 、プ
ラセボ群: 0.2%)。
日本人部分集団を対象とした解析では、最も一般的な局所反応は注射部位疼痛であった(ワクチン群:
37.8% 、プラセボ群: 9.9%)
。全身反応の発現率は、筋肉痛(ワクチン群: 14.3%、プラセボ群: 1.7%)を
除いて、両群間で差は認めなかった。AEs・SAEs は、それぞれ AEs(ワクチン群: 16.1%、プラセボ群:
19.8%)
、SAEs(ワクチン群: 20.0%、プラセボ群: 14.7%)と、全体集団と同様に両群間で差は認めなか
った。日本人部分集団において、母体における安全性の傾向は、国際共同治験全体の結果と一致してい
た。
日本において、ワクチン接種後の安全性に関する単一施設による後方視的検討が報告されており、2024
年6月~11 月にワクチンを接種した 280 名(うち分娩に至った 206 例)と 2023 年に分娩した 1,431 例
を対象に解析が行われている 98。ワクチン接種した 280 名において、接種時に対応を要する有害事象発
症例はなかった。分娩例において、接種群は早産 10 例(4.9%)であり、対照群の 4.3%と有意差は認め
なかった(p 値=0.78)
。著者は、
「ワクチン接種時に有害な事象は観察されず、周産期にも問題となる事
象は生じなかった。これらは第 3 相試験の結果とも合致している。」と結論づけている。
2)乳児における安全性
MATISSE 試験においては、出生後 1 か月以内に報告された乳児の AEs・SAEs の発現率はともに同程
度で AEs(ワクチン群: 38.0%、プラセボ群: 35.4%)
、SAEs(ワクチン群: 16.3%、プラセボ群: 16.1%)
28
表 3.
MATISSE 試験に関する文献一覧
研究
組入れ数
概要
妊婦
出生乳児
ワクチン群
プラセボ群
ワクチン群
プラセボ群
〔例〕
〔例〕
〔例〕
〔例〕
3,695
3,697
3,570
3,558
初回解析
Simoes et al. (2025) 76
3,711
3,709
3,660
3,647
最終解析
Madhi et al. (2025) 97
3,698
3,688
3,660
3,647
早産に関する最終解析
Otsuki et al. (2024) 79
230
232
218
216
日本人部分集団に対する解析
Kampmann et al.
(2023)68
1)母体における安全性
MATISSE 試験においては、ワクチン接種後 7 日間の注射部位疼痛、発赤、腫脹などの局所反応のなか
で、最も一般的な局所反応は注射部位疼痛であった(ワクチン群: 41%、プラセボ群: 10%)
。これらの大
部分は軽度から中等度であり、通常 2 日~3 日で消失した。全身反応の発現率は、筋肉痛(ワクチン群:
27%、プラセボ群: 17%)と頭痛(ワクチン群: 31%、プラセボ群: 28%)を除いて、両群間で差は認めな
かった。ワクチン接種後 1 か月以内に報告された有害事象(AEs)の発現率も、両群間で差は認めなかっ
た(ワクチン群: 14.0%、プラセボ群: 13.2%)
。重篤な有害事象(SAEs)の発現率も、両群間で差は認め
なかった(ワクチン群: 4.3% 、プラセボ群: 3.8%)
。SAEs のうち投与薬との関連があるとされた事象は
4 例(ワクチン群:四肢痛、切迫早産、子癇が各 1 例、プラセボ群:胎盤早期剥離 1 例)であり、これら
の転帰はいずれも回復であった。死産についても、両群間で差は認めなかった(ワクチン群: 0.3% 、プ
ラセボ群: 0.2%)。
日本人部分集団を対象とした解析では、最も一般的な局所反応は注射部位疼痛であった(ワクチン群:
37.8% 、プラセボ群: 9.9%)
。全身反応の発現率は、筋肉痛(ワクチン群: 14.3%、プラセボ群: 1.7%)を
除いて、両群間で差は認めなかった。AEs・SAEs は、それぞれ AEs(ワクチン群: 16.1%、プラセボ群:
19.8%)
、SAEs(ワクチン群: 20.0%、プラセボ群: 14.7%)と、全体集団と同様に両群間で差は認めなか
った。日本人部分集団において、母体における安全性の傾向は、国際共同治験全体の結果と一致してい
た。
日本において、ワクチン接種後の安全性に関する単一施設による後方視的検討が報告されており、2024
年6月~11 月にワクチンを接種した 280 名(うち分娩に至った 206 例)と 2023 年に分娩した 1,431 例
を対象に解析が行われている 98。ワクチン接種した 280 名において、接種時に対応を要する有害事象発
症例はなかった。分娩例において、接種群は早産 10 例(4.9%)であり、対照群の 4.3%と有意差は認め
なかった(p 値=0.78)
。著者は、
「ワクチン接種時に有害な事象は観察されず、周産期にも問題となる事
象は生じなかった。これらは第 3 相試験の結果とも合致している。」と結論づけている。
2)乳児における安全性
MATISSE 試験においては、出生後 1 か月以内に報告された乳児の AEs・SAEs の発現率はともに同程
度で AEs(ワクチン群: 38.0%、プラセボ群: 35.4%)
、SAEs(ワクチン群: 16.3%、プラセボ群: 16.1%)
28