よむ、つかう、まなぶ。
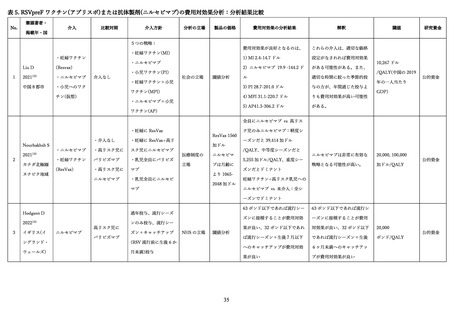
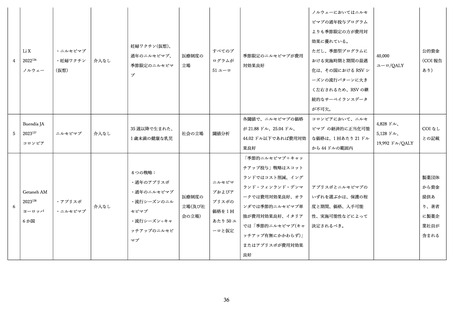
05資料2-1森野委員提出資料(RSウイルス母子免疫ワクチンと抗体製剤ファクトシート) (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64997.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第32回 10/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
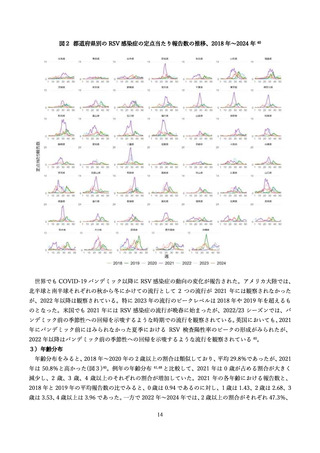
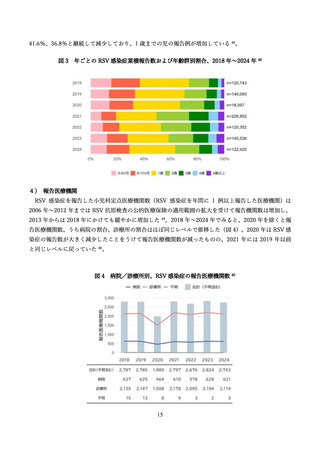
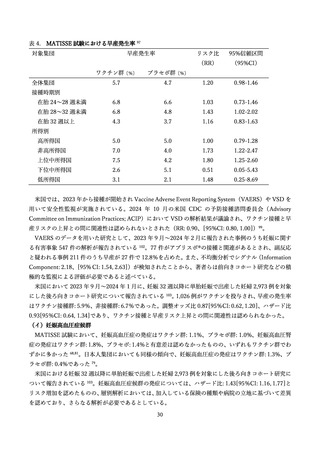
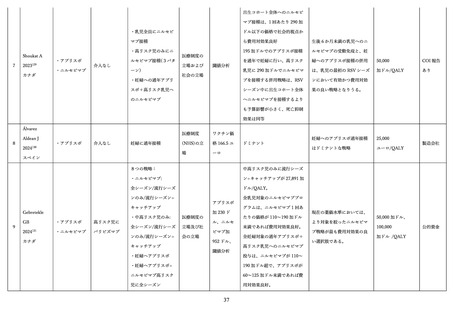
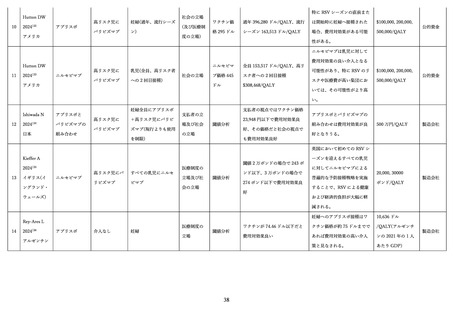
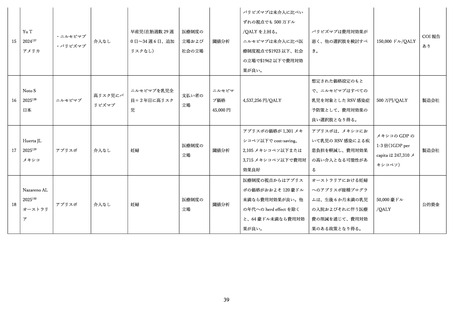
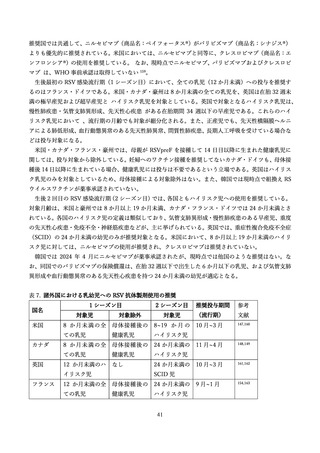
2)有効性
(ア)臨床試験
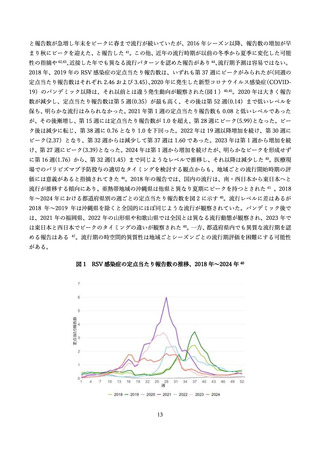
表 2 に組換え RS ウイルスワクチン母体接種による各種評価項目に対する有効性(vaccine efficacy)評
価に関する前述の第 3 相 MATISSE 試験対象者の主解析結果、および、その最終解析結果 76、日本人部分
集団 79 の解析結果を記す。加えて、米国ワクチン接種に関する諮問委員会(Advisory Committee on
Immunization Practices; ACIP)のワーキンググループによる評価に用いられた第 3 相試験の結果を用い
た追加解析結果 80,81(表内*)を併せて記載した。
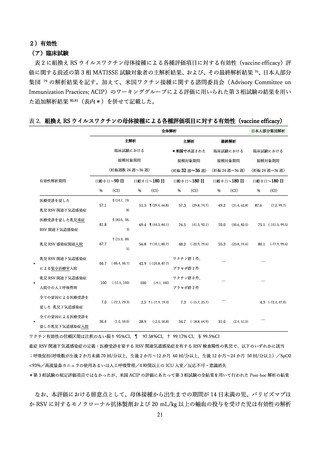
表 2.組換え RS ウイルスワクチンの母体接種による各種評価項目に対する有効性(vaccine efficacy)
全体解析
主解析
主解析
最終解析
臨床試験における
*米国で承認された
臨床試験における
臨床試験における
接種対象期間
接種対象期間
接種対象期間
接種対象期間
(妊娠週数 24 週~36 週)
有効性解析期間
日齢 0 日~90 日
%
医療受診を要した
日本人部分集団解析
(妊娠 32 週~36 週) (妊娠 24 週~36 週) (妊娠 24 週~36 週)
日齢 0 日~180 日
(CI)
%
(CI)
日齢 0 日~180 日
%
(CI)
日齢 0 日~180 日
%
(CI)
日齢 0 日~180 日
%
(CI)
§(14.7, 79.
57.1
乳児 RSV 関連下気道感染症
51.3 ¶(29.4, 66.8)
57.3
(29.8, 74.7)
49.2
(31.4, 62.8)
87.6
69.4 ¶(44.3, 84.1)
76.5
(41.3, 92.1)
70.0
(50.6, 82.5)
75.1 (-151.5, 99.5)
56.8 †(10.1, 80.7)
48.2
(–22.9, 79.6)
55.3
(23.8, 74.6)
80.1
(7.2, 99.7)
8)
医療受診を要した乳児重症
§(40.6, 96.
81.8
RSV 関連下気道感染症
3)
†(15.9, 89.
乳児 RSV 感染症関連入院
67.7
(-77.9, 99.6)
5)
乳児 RSV 関連下気道感染症
ワクチン群 1 件,
66.7
*
(-86.4, 96.7)
42.9 (-124.8, 87.7)
による集中治療室入院
乳児 RSV 関連下気道感染症
 ̄
 ̄
 ̄
4.3 (-72.4, 47.0)
ワクチン群 0 件,
100
*
 ̄
プラセボ群 2 件
(-51.5, 100)
100
(-9.1, 100)
入院中の人工呼吸管理
プラセボ群 2 件
全ての要因による医療受診を
7.0
(-22.3, 29.3)
36.4
(1.0, 59.6)
2.5 †(-17.9, 19.4)
7.3
(–15.7, 25.7)
 ̄
28.9
34.7
(–18.8, 64.9)
31.0
要した 乳児下気道感染症
全ての要因による医療受診を
*
(–2.0, 50.8)
(2.4, 51.5)
 ̄
要した乳児下気道感染症入院
ワクチン有効性の信頼区間は注釈のない限り 95%CI,¶ 97.58%CI,† 99.17% CI,§ 99.5%CI
重症 RSV 関連下気道感染症の定義:医療受診を要する RSV 関連気道感染症を有する RSV 検査陽性の乳児で、以下のいずれかに該当
;呼吸促拍(呼吸数が生後 2 か月未満 70 回/分以上,生後 2 か月~12 か月 60 回/分以上,生後 12 か月~24 か月 50 回/分以上) /SpO2
<93%/高流量鼻カニュラの使用あるいは人工呼吸管理/4 時間以上の ICU 入室/反応不可・意識消失
*第 3 相試験の規定評価項目ではなかったが、米国 ACIP の評価にあたって第 3 相試験の全結果を用いて行われた Post-hoc 解析の結果
なお、本評価における留意点として、母体接種から出生までの期間が 14 日未満の児、パリビズマブほ
か RSV に対するモノクローナル抗体製剤および 20 mL/kg 以上の輸血の投与を受けた児は有効性の解析
21
(ア)臨床試験
表 2 に組換え RS ウイルスワクチン母体接種による各種評価項目に対する有効性(vaccine efficacy)評
価に関する前述の第 3 相 MATISSE 試験対象者の主解析結果、および、その最終解析結果 76、日本人部分
集団 79 の解析結果を記す。加えて、米国ワクチン接種に関する諮問委員会(Advisory Committee on
Immunization Practices; ACIP)のワーキンググループによる評価に用いられた第 3 相試験の結果を用い
た追加解析結果 80,81(表内*)を併せて記載した。
表 2.組換え RS ウイルスワクチンの母体接種による各種評価項目に対する有効性(vaccine efficacy)
全体解析
主解析
主解析
最終解析
臨床試験における
*米国で承認された
臨床試験における
臨床試験における
接種対象期間
接種対象期間
接種対象期間
接種対象期間
(妊娠週数 24 週~36 週)
有効性解析期間
日齢 0 日~90 日
%
医療受診を要した
日本人部分集団解析
(妊娠 32 週~36 週) (妊娠 24 週~36 週) (妊娠 24 週~36 週)
日齢 0 日~180 日
(CI)
%
(CI)
日齢 0 日~180 日
%
(CI)
日齢 0 日~180 日
%
(CI)
日齢 0 日~180 日
%
(CI)
§(14.7, 79.
57.1
乳児 RSV 関連下気道感染症
51.3 ¶(29.4, 66.8)
57.3
(29.8, 74.7)
49.2
(31.4, 62.8)
87.6
69.4 ¶(44.3, 84.1)
76.5
(41.3, 92.1)
70.0
(50.6, 82.5)
75.1 (-151.5, 99.5)
56.8 †(10.1, 80.7)
48.2
(–22.9, 79.6)
55.3
(23.8, 74.6)
80.1
(7.2, 99.7)
8)
医療受診を要した乳児重症
§(40.6, 96.
81.8
RSV 関連下気道感染症
3)
†(15.9, 89.
乳児 RSV 感染症関連入院
67.7
(-77.9, 99.6)
5)
乳児 RSV 関連下気道感染症
ワクチン群 1 件,
66.7
*
(-86.4, 96.7)
42.9 (-124.8, 87.7)
による集中治療室入院
乳児 RSV 関連下気道感染症
 ̄
 ̄
 ̄
4.3 (-72.4, 47.0)
ワクチン群 0 件,
100
*
 ̄
プラセボ群 2 件
(-51.5, 100)
100
(-9.1, 100)
入院中の人工呼吸管理
プラセボ群 2 件
全ての要因による医療受診を
7.0
(-22.3, 29.3)
36.4
(1.0, 59.6)
2.5 †(-17.9, 19.4)
7.3
(–15.7, 25.7)
 ̄
28.9
34.7
(–18.8, 64.9)
31.0
要した 乳児下気道感染症
全ての要因による医療受診を
*
(–2.0, 50.8)
(2.4, 51.5)
 ̄
要した乳児下気道感染症入院
ワクチン有効性の信頼区間は注釈のない限り 95%CI,¶ 97.58%CI,† 99.17% CI,§ 99.5%CI
重症 RSV 関連下気道感染症の定義:医療受診を要する RSV 関連気道感染症を有する RSV 検査陽性の乳児で、以下のいずれかに該当
;呼吸促拍(呼吸数が生後 2 か月未満 70 回/分以上,生後 2 か月~12 か月 60 回/分以上,生後 12 か月~24 か月 50 回/分以上) /SpO2
<93%/高流量鼻カニュラの使用あるいは人工呼吸管理/4 時間以上の ICU 入室/反応不可・意識消失
*第 3 相試験の規定評価項目ではなかったが、米国 ACIP の評価にあたって第 3 相試験の全結果を用いて行われた Post-hoc 解析の結果
なお、本評価における留意点として、母体接種から出生までの期間が 14 日未満の児、パリビズマブほ
か RSV に対するモノクローナル抗体製剤および 20 mL/kg 以上の輸血の投与を受けた児は有効性の解析
21