よむ、つかう、まなぶ。
再生医療等提供計画等の記載要領等について[2.0MB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
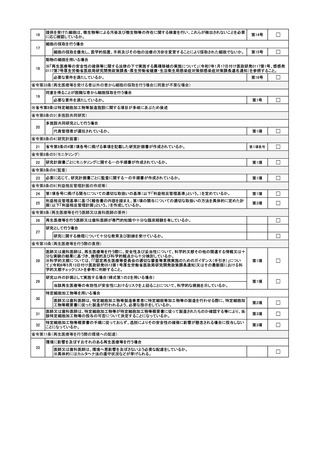
承認番号を記載すること。
「再生医療等製品等の投与の方法」欄について
投与を行う場所(例:手術室)及び科学的根拠に基づいた投与方法(投与量や投
与速度を含む。
)や投与回数、投与間隔等について具体的に記載すること。
(4) 再生医療等に用いる未承認又は適応外の医薬品又は医療機器に関する事項(未承認
又は適応外の医薬品又は医療機器を用いる場合のみ記載)
対照薬や評価する併用薬(併用療法を評価している場合に併用している医薬品等。
再生医療等技術として用いる場合を除く。)が対象となる。
「一般的名称等」欄の「医薬品:一般的名称(国内外で未承認の場合は開発コード
を記載すること)
」欄について
後発品が多い場合は、主となる薬剤を記載の上、
「○○等」と省略して差し支え
ない。
「一般的名称等」欄の「医療機器」欄について
承認・認証・届出がなされている医療機器については番号を記入するとともに、
注意事項等情報中にある一般的名称・類別を参照して記載すること。承認・認証・
届出されていない医療機器については、医薬品医療機器総合機構(PMDA)のウェブ
サイトを参照の上、一般的名称の定義を元に、類別及び一般的名称を記載すること。
(https://www.std.pmda.go.jp/stdDB/index_jmdn.html)
「医薬品又は医療機器の提供者」の欄について
後発品が多い場合は、主となる提供者名を記載の上、「○○等」と省略して差し
支えない。
4
再生医療等技術の安全性の確保等に関する措置
(1) 利益相反管理に関する事項
① 再生医療等に対する特定細胞加工物等製造事業者からの研究資金等の提供その他の
関与
「契約締結日」欄について
認定再生医療等委員会への新規申請時は空欄で可。厚生労働大臣届出時は、契約
締結日を記載すること(届出後の締結の場合は変更届を提出し、契約締結までは研
究を開始できないよう留意すること。
)。
② 再生医療等に対する医薬品等製造販売業者等からの研究資金等の提供その他の関与
「契約締結日」欄について
認定再生医療等委員会への新規申請時は空欄で可。厚生労働大臣届出時は、契約
締結日を記載すること(届出後の締結の場合は変更届を提出し、契約締結までは研
究を開始できないよう留意すること)。
「再生医療等製品等の投与の方法」欄について
投与を行う場所(例:手術室)及び科学的根拠に基づいた投与方法(投与量や投
与速度を含む。
)や投与回数、投与間隔等について具体的に記載すること。
(4) 再生医療等に用いる未承認又は適応外の医薬品又は医療機器に関する事項(未承認
又は適応外の医薬品又は医療機器を用いる場合のみ記載)
対照薬や評価する併用薬(併用療法を評価している場合に併用している医薬品等。
再生医療等技術として用いる場合を除く。)が対象となる。
「一般的名称等」欄の「医薬品:一般的名称(国内外で未承認の場合は開発コード
を記載すること)
」欄について
後発品が多い場合は、主となる薬剤を記載の上、
「○○等」と省略して差し支え
ない。
「一般的名称等」欄の「医療機器」欄について
承認・認証・届出がなされている医療機器については番号を記入するとともに、
注意事項等情報中にある一般的名称・類別を参照して記載すること。承認・認証・
届出されていない医療機器については、医薬品医療機器総合機構(PMDA)のウェブ
サイトを参照の上、一般的名称の定義を元に、類別及び一般的名称を記載すること。
(https://www.std.pmda.go.jp/stdDB/index_jmdn.html)
「医薬品又は医療機器の提供者」の欄について
後発品が多い場合は、主となる提供者名を記載の上、「○○等」と省略して差し
支えない。
4
再生医療等技術の安全性の確保等に関する措置
(1) 利益相反管理に関する事項
① 再生医療等に対する特定細胞加工物等製造事業者からの研究資金等の提供その他の
関与
「契約締結日」欄について
認定再生医療等委員会への新規申請時は空欄で可。厚生労働大臣届出時は、契約
締結日を記載すること(届出後の締結の場合は変更届を提出し、契約締結までは研
究を開始できないよう留意すること。
)。
② 再生医療等に対する医薬品等製造販売業者等からの研究資金等の提供その他の関与
「契約締結日」欄について
認定再生医療等委員会への新規申請時は空欄で可。厚生労働大臣届出時は、契約
締結日を記載すること(届出後の締結の場合は変更届を提出し、契約締結までは研
究を開始できないよう留意すること)。