よむ、つかう、まなぶ。
再生医療等提供計画等の記載要領等について[2.0MB] (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
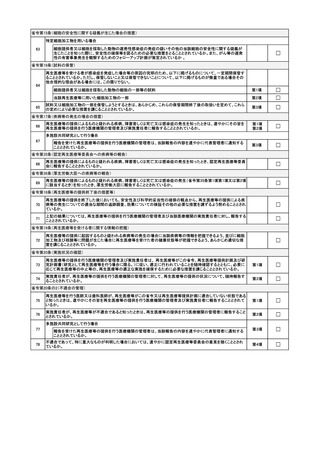
16
17
提供を受けた細胞は、微生物等による汚染及び微生物等の存在に関する検査を行い、これらが検出されないことを必要
に応じ確認しているか。
第14号
☐
第15号
☐
細胞の採取を行う場合
細胞の採取を優先し、医学的処置、手術及びその他の治療の方針を変更することにより採取された細胞でないか。
動物の細胞を用いる場合
18
※「再生医療等の安全性の確保等に関する法律の下で実施する異種移植の実施について」(令和7年1月17日付け医政研発0117第1号、感感発
0117第7号厚生労働省医政局研究開発政策課長・厚生労働省健康・生活衛生局感染症対策部感染症対策課長連名通知)を参照すること。
必要な要件を満たしているか。
第16号
☐
第1号
☐
第1項
☐
第1項各号
☐
第1項
☐
第1項
☐
省令第33条(再生医療等を受ける者以外の者から細胞の採取を行う場合に同意が不要な場合)
19
同意を得ることが困難な者から細胞採取を行う場合
必要な要件を満たしているか。
※省令第8条は特定細胞加工物等製造施設に関する項目が多岐に及ぶため後述
省令第8条の3(多施設共同研究)
20
多施設共同研究として行う場合
代表管理者が選任されているか。
省令第8条の4(研究計画書)
21
省令第8条の4第1項各号に掲げる事項を記載した研究計画書が作成されているか。
省令第8条の5(モニタリング)
22
研究計画書ごとにモニタリングに関する一の手順書が作成されているか。
省令第8条の6(監査)
23
必要に応じて、研究計画書ごとに監査に関する一の手順書が作成されているか。
省令第8条の8(利益相反管理計画の作成等)
24
第1項各号に掲げる関与についての適切な取扱いの基準(以下「利益相反管理基準」という。)を定めているか。
第1項
☐
25
利益相反管理基準に基づく報告書の内容を踏まえ、第1項の関与についての適切な取扱いの方法を具体的に定めた計
画(以下「利益相反管理計画」という。)を作成しているか。
第3項
☐
省令第9条(再生医療等を行う医師又は歯科医師の要件)
26
27
☐
再生医療等を行う医師又は歯科医師が専門的知識や十分な臨床経験を有しているか。
研究として行う場合
☐
研究に関する倫理について十分な教育及び訓練を受けているか。
省令第10条(再生医療等を行う際の責務)
医師又は歯科医師は、再生医療等を行う際に、安全性及び妥当性について、科学的文献その他の関連する情報又は十
分な実験の結果に基づき、倫理的及び科学的観点から十分検討しているか。
※科学的文献については、「「認定再生医療等委員会の適切な審査等業務実施のためのガイダンス(手引き)」につい
て」(令和6年5月13日付け医政研発0513第1号厚生労働省医政局研究開発政策課長通知)又はその最新版における科
学的文献チェックリストを参考に判断すること。
第1項
☐
第1項
☐
医師又は歯科医師は、特定細胞加工物等製造事業者に特定細胞等加工物等の製造を行わせる際に、特定細胞加
工物等概要書に従った製造が行われるよう、必要な指示をしているか。
第2項
☐
31
医師又は歯科医師は、特定細胞加工物等が特定細胞加工物等概要書に従って製造されたものか確認する等により、当
該特定細胞加工物等の投与の可否について決定することになっているか。
第3項
☐
32
特定細胞加工物等概要書の手順に従っておらず、逸脱によりその安全性の確保に影響が懸念される場合に投与しない
ことになっているか。
第3項
☐
28
29
研究以外の計画として実施する場合(様式第1の2を用いる場合)
当該再生医療等の有効性が安全性におけるリスクを上回ることについて、科学的な根拠を示しているか。
特定細胞加工物等を用いる場合
30
省令第11条(再生医療等を行う際の環境への配慮)
環境に影響を及ぼすおそれのある再生医療等を行う場合
33
医師又は歯科医師は、環境へ悪影響を及ぼさないよう必要な配慮をしているか。
※具体的にはカルタヘナ法の遵守状況などが挙げられる。
☐
17
提供を受けた細胞は、微生物等による汚染及び微生物等の存在に関する検査を行い、これらが検出されないことを必要
に応じ確認しているか。
第14号
☐
第15号
☐
細胞の採取を行う場合
細胞の採取を優先し、医学的処置、手術及びその他の治療の方針を変更することにより採取された細胞でないか。
動物の細胞を用いる場合
18
※「再生医療等の安全性の確保等に関する法律の下で実施する異種移植の実施について」(令和7年1月17日付け医政研発0117第1号、感感発
0117第7号厚生労働省医政局研究開発政策課長・厚生労働省健康・生活衛生局感染症対策部感染症対策課長連名通知)を参照すること。
必要な要件を満たしているか。
第16号
☐
第1号
☐
第1項
☐
第1項各号
☐
第1項
☐
第1項
☐
省令第33条(再生医療等を受ける者以外の者から細胞の採取を行う場合に同意が不要な場合)
19
同意を得ることが困難な者から細胞採取を行う場合
必要な要件を満たしているか。
※省令第8条は特定細胞加工物等製造施設に関する項目が多岐に及ぶため後述
省令第8条の3(多施設共同研究)
20
多施設共同研究として行う場合
代表管理者が選任されているか。
省令第8条の4(研究計画書)
21
省令第8条の4第1項各号に掲げる事項を記載した研究計画書が作成されているか。
省令第8条の5(モニタリング)
22
研究計画書ごとにモニタリングに関する一の手順書が作成されているか。
省令第8条の6(監査)
23
必要に応じて、研究計画書ごとに監査に関する一の手順書が作成されているか。
省令第8条の8(利益相反管理計画の作成等)
24
第1項各号に掲げる関与についての適切な取扱いの基準(以下「利益相反管理基準」という。)を定めているか。
第1項
☐
25
利益相反管理基準に基づく報告書の内容を踏まえ、第1項の関与についての適切な取扱いの方法を具体的に定めた計
画(以下「利益相反管理計画」という。)を作成しているか。
第3項
☐
省令第9条(再生医療等を行う医師又は歯科医師の要件)
26
27
☐
再生医療等を行う医師又は歯科医師が専門的知識や十分な臨床経験を有しているか。
研究として行う場合
☐
研究に関する倫理について十分な教育及び訓練を受けているか。
省令第10条(再生医療等を行う際の責務)
医師又は歯科医師は、再生医療等を行う際に、安全性及び妥当性について、科学的文献その他の関連する情報又は十
分な実験の結果に基づき、倫理的及び科学的観点から十分検討しているか。
※科学的文献については、「「認定再生医療等委員会の適切な審査等業務実施のためのガイダンス(手引き)」につい
て」(令和6年5月13日付け医政研発0513第1号厚生労働省医政局研究開発政策課長通知)又はその最新版における科
学的文献チェックリストを参考に判断すること。
第1項
☐
第1項
☐
医師又は歯科医師は、特定細胞加工物等製造事業者に特定細胞等加工物等の製造を行わせる際に、特定細胞加
工物等概要書に従った製造が行われるよう、必要な指示をしているか。
第2項
☐
31
医師又は歯科医師は、特定細胞加工物等が特定細胞加工物等概要書に従って製造されたものか確認する等により、当
該特定細胞加工物等の投与の可否について決定することになっているか。
第3項
☐
32
特定細胞加工物等概要書の手順に従っておらず、逸脱によりその安全性の確保に影響が懸念される場合に投与しない
ことになっているか。
第3項
☐
28
29
研究以外の計画として実施する場合(様式第1の2を用いる場合)
当該再生医療等の有効性が安全性におけるリスクを上回ることについて、科学的な根拠を示しているか。
特定細胞加工物等を用いる場合
30
省令第11条(再生医療等を行う際の環境への配慮)
環境に影響を及ぼすおそれのある再生医療等を行う場合
33
医師又は歯科医師は、環境へ悪影響を及ぼさないよう必要な配慮をしているか。
※具体的にはカルタヘナ法の遵守状況などが挙げられる。
☐