よむ、つかう、まなぶ。
再生医療等提供計画等の記載要領等について[2.0MB] (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
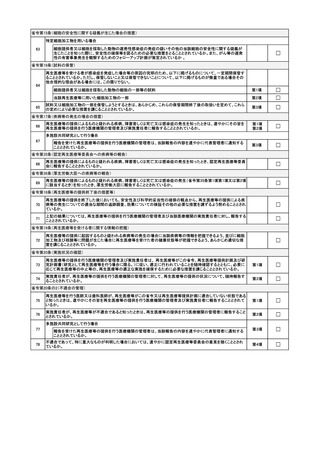
省令第34条(再生医療等に関する記録及び保存)
92
☐
再生医療等に関する記録は、再生医療等を受けた者ごとに記録し保存することとなっているか。
省令第37条(認定再生医療等委員会への定期報告)
93
☐
再生医療等の提供状況を認定再生医療等委員会に定期的に報告することとなっているか。
省令第38条(厚生労働大臣への定期報告)
94
☐
再生医療等の提供状況を厚生労働大臣に定期的に報告することとなっているか。
省令第40条(認定再生医療等委員会の審査等業務に係る契約)
95
☐
審査等業務を行わせることとした認定再生医療等委員会と、あらかじめ文書により契約を締結しているか。
省令第41条(講じた措置についての認定再生医療等委員会への報告)
96
認定再生医療等委員会から意見を受けて講じた再生医療等提供計画の変更その他の措置について、当該委員会に報
告を行うこととなっているか。
☐
3.再生医療提供機関と認定再生医療等委員会の関係において確認が求められる事項
確認事項
番号
対応する
条項等
確認欄
省令第27条第6項第5号及び第65条第1項第3号
97
再生医療等提供計画に記載のある「審査等業務の対象となる再生医療等提供計画に関する役務の提供の有無及びそ
の内容」について、省令第65条第1項第3号に規定する「再生医療等提供計画に関する役務の提供を行った者又は当該
者と密接な関係にある者」に該当する者が審査等業務に参加していないか。
☐
4.特定細胞加工物等製造施設の項目について
確認事項
対応する
条項等
確認欄
98
当該特定細胞加工物等の名称、構成細胞及び製造方法等を記載した特定細胞加工物等概要書が作成されているか。
第1項
☐
99
再生医療等の提供を行う医療機関の管理者は、特定細胞加工物等製造事業者に、法第44条(※)に規定する特定細胞
加工物等製造事業者の業務に関し遵守すべき事項に従って特定細胞加工物等製造施設における特定細胞加工物等の
製造及び品質管理を行わせているか。
第2項
☐
番号
省令第8条(特定細胞加工物等の製造及び品質管理の方法)
※以下、法第44条に規定する項目
省令第92条(品質リスクマネジメント)
100
製造管理及び品質管理を行う際に、品質リスクマネジメントの活用を考慮しているか。
例)・ 細胞加工に用いる重要な原料や生成する核酸等の品質管理受け入れ基準等を設けているか。
・導入又は加工に用いるウイルスベクターやプラスミド、タンパク質、mRNAなどの品質試験結果を保管しているか。
※品質マネジメントの実施にあたってはICH-Q9(R1) 「品質リスクマネジメントに関するガイドライン」又はその最新版を参
考とすること。
☐
省令第93条(製造部門及び品質部門)
101
施設管理者の監督の下に、製造管理に係る部門及び品質管理に係る部門を置いているか。
第1項
102
品質部門は製造部門から独立しているか。
第2項
☐
☐
省令第94条(施設管理者)
103
☐
施設管理者が、製造・品質管理業務を適切に総括及び管理監督できる体制が構築されているか。
省令第95条(職員)
104
業務責任者の適切な配置がなされているか。また、製造・品質管理業務に従事する職員の人員を十分に確保し、その責
務及び管理体制を文書により適切に定めているか。
☐
省令第96条(特定細胞加工物等標準書)
105
特定細胞加工物等ごとに、特定細胞加工物等標準書を特定細胞加工物等製造施設ごとに作成し、保管するとともに、品
質部門の承認を受けているか。
☐
特定細胞加工物等標準書について以下に掲げる事項について記載されているか。
106
特定細胞加工物等概要書記載事項
第1号
製造手順
第2号
品質に関する事項
第3号
その他所要の事項
第4号
☐
☐
☐
☐
92
☐
再生医療等に関する記録は、再生医療等を受けた者ごとに記録し保存することとなっているか。
省令第37条(認定再生医療等委員会への定期報告)
93
☐
再生医療等の提供状況を認定再生医療等委員会に定期的に報告することとなっているか。
省令第38条(厚生労働大臣への定期報告)
94
☐
再生医療等の提供状況を厚生労働大臣に定期的に報告することとなっているか。
省令第40条(認定再生医療等委員会の審査等業務に係る契約)
95
☐
審査等業務を行わせることとした認定再生医療等委員会と、あらかじめ文書により契約を締結しているか。
省令第41条(講じた措置についての認定再生医療等委員会への報告)
96
認定再生医療等委員会から意見を受けて講じた再生医療等提供計画の変更その他の措置について、当該委員会に報
告を行うこととなっているか。
☐
3.再生医療提供機関と認定再生医療等委員会の関係において確認が求められる事項
確認事項
番号
対応する
条項等
確認欄
省令第27条第6項第5号及び第65条第1項第3号
97
再生医療等提供計画に記載のある「審査等業務の対象となる再生医療等提供計画に関する役務の提供の有無及びそ
の内容」について、省令第65条第1項第3号に規定する「再生医療等提供計画に関する役務の提供を行った者又は当該
者と密接な関係にある者」に該当する者が審査等業務に参加していないか。
☐
4.特定細胞加工物等製造施設の項目について
確認事項
対応する
条項等
確認欄
98
当該特定細胞加工物等の名称、構成細胞及び製造方法等を記載した特定細胞加工物等概要書が作成されているか。
第1項
☐
99
再生医療等の提供を行う医療機関の管理者は、特定細胞加工物等製造事業者に、法第44条(※)に規定する特定細胞
加工物等製造事業者の業務に関し遵守すべき事項に従って特定細胞加工物等製造施設における特定細胞加工物等の
製造及び品質管理を行わせているか。
第2項
☐
番号
省令第8条(特定細胞加工物等の製造及び品質管理の方法)
※以下、法第44条に規定する項目
省令第92条(品質リスクマネジメント)
100
製造管理及び品質管理を行う際に、品質リスクマネジメントの活用を考慮しているか。
例)・ 細胞加工に用いる重要な原料や生成する核酸等の品質管理受け入れ基準等を設けているか。
・導入又は加工に用いるウイルスベクターやプラスミド、タンパク質、mRNAなどの品質試験結果を保管しているか。
※品質マネジメントの実施にあたってはICH-Q9(R1) 「品質リスクマネジメントに関するガイドライン」又はその最新版を参
考とすること。
☐
省令第93条(製造部門及び品質部門)
101
施設管理者の監督の下に、製造管理に係る部門及び品質管理に係る部門を置いているか。
第1項
102
品質部門は製造部門から独立しているか。
第2項
☐
☐
省令第94条(施設管理者)
103
☐
施設管理者が、製造・品質管理業務を適切に総括及び管理監督できる体制が構築されているか。
省令第95条(職員)
104
業務責任者の適切な配置がなされているか。また、製造・品質管理業務に従事する職員の人員を十分に確保し、その責
務及び管理体制を文書により適切に定めているか。
☐
省令第96条(特定細胞加工物等標準書)
105
特定細胞加工物等ごとに、特定細胞加工物等標準書を特定細胞加工物等製造施設ごとに作成し、保管するとともに、品
質部門の承認を受けているか。
☐
特定細胞加工物等標準書について以下に掲げる事項について記載されているか。
106
特定細胞加工物等概要書記載事項
第1号
製造手順
第2号
品質に関する事項
第3号
その他所要の事項
第4号
☐
☐
☐
☐