よむ、つかう、まなぶ。
再生医療等提供計画等の記載要領等について[2.0MB] (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
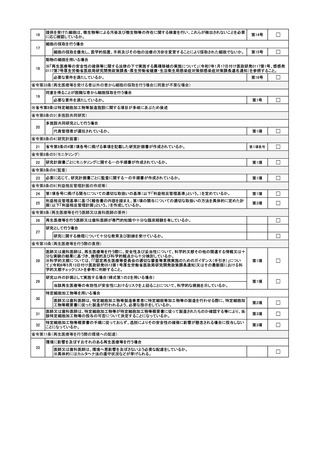
内容を記載すること。
「苦情及び問合せへの対応に関する体制の整備状況」欄について
苦情及び問合せを受けるための窓口、対応の手順について記載すること。
「添付資料」について
(1) 認定再生医療等委員会意見書
再生医療等提供計画に記載した認定再生医療等委員会が述べた意見書(別紙様
式第5)の写し、審査等業務の過程に関する記録の写し及び当該認定再生医療等委
員会が記載した再生医療等提供基準等チェックリストの写しを添付すること。
(2) 提供する再生医療等の詳細を記した書類
再生医療等の提供方法等の詳細及び次に掲げる事項が記載されたものを添付す
ること。
①
細胞の入手の方法(特定細胞加工物を用いる場合に限る。)
イ
細胞の提供を受けた後に再検査を行う場合はその方法
ロ
細胞の提供を受ける際の微生物等による汚染を防ぐための措置
ハ
採取した細胞について微生物等の存在に関する検査を行う場合はその内容
ニ
厚生労働大臣が定めるES細胞の樹立に関する指針に従ったものである場
合は、その旨を証明する書類
②
環境への配慮の内容(環境に影響を及ぼすおそれのある再生医療等を行う場合)
遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律
(平成 15 年法律第 97 号)の規定に基づく遺伝子組換え生物等を用いた再生医療
等を行う場合に同法の規定を遵守して適切に実施するために必要な事項について
記載したものを添付すること。具体的な手続等については、
「再生医療等の安全性
の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使
用等の規制による生物の多様性の確保に関する法律」に基づく手続等について」
(令和7年5月 30 日付け医政研発 0530 第1号厚生労働省医政局研究開発政策課
長通知)を参照すること。
③
細胞の安全性に関する疑義が生じた場合の安全性の確保等を図るための措置の内
容(特定細胞加工物を用いる場合に限る。)
④
再生医療等を受ける者の健康状態等を把握するための把握の内容
⑤
核酸等を用いる場合に記載及び添付が必要な事項(核酸等を用いる場合に限る。)
「核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提
供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必
要な事項について」
(令和7年5月 30 日付け医政研発 0530 第5号厚生労働省医政
局研究開発政策課長通知)に基づく記載事項について記載するとともに必要な書
類を添付すること。
(3) 実施責任者及び再生医療等を行う医師又は歯科医師の氏名、所属、役職及び略歴(再
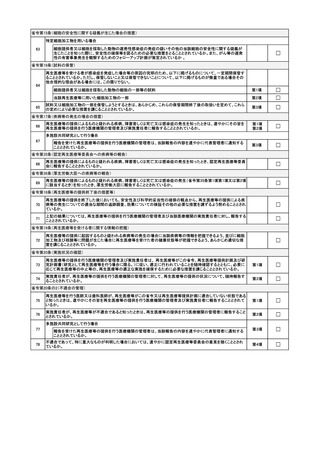
「苦情及び問合せへの対応に関する体制の整備状況」欄について
苦情及び問合せを受けるための窓口、対応の手順について記載すること。
「添付資料」について
(1) 認定再生医療等委員会意見書
再生医療等提供計画に記載した認定再生医療等委員会が述べた意見書(別紙様
式第5)の写し、審査等業務の過程に関する記録の写し及び当該認定再生医療等委
員会が記載した再生医療等提供基準等チェックリストの写しを添付すること。
(2) 提供する再生医療等の詳細を記した書類
再生医療等の提供方法等の詳細及び次に掲げる事項が記載されたものを添付す
ること。
①
細胞の入手の方法(特定細胞加工物を用いる場合に限る。)
イ
細胞の提供を受けた後に再検査を行う場合はその方法
ロ
細胞の提供を受ける際の微生物等による汚染を防ぐための措置
ハ
採取した細胞について微生物等の存在に関する検査を行う場合はその内容
ニ
厚生労働大臣が定めるES細胞の樹立に関する指針に従ったものである場
合は、その旨を証明する書類
②
環境への配慮の内容(環境に影響を及ぼすおそれのある再生医療等を行う場合)
遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律
(平成 15 年法律第 97 号)の規定に基づく遺伝子組換え生物等を用いた再生医療
等を行う場合に同法の規定を遵守して適切に実施するために必要な事項について
記載したものを添付すること。具体的な手続等については、
「再生医療等の安全性
の確保等に関する法律に基づく再生医療等に関連した「遺伝子組換え生物等の使
用等の規制による生物の多様性の確保に関する法律」に基づく手続等について」
(令和7年5月 30 日付け医政研発 0530 第1号厚生労働省医政局研究開発政策課
長通知)を参照すること。
③
細胞の安全性に関する疑義が生じた場合の安全性の確保等を図るための措置の内
容(特定細胞加工物を用いる場合に限る。)
④
再生医療等を受ける者の健康状態等を把握するための把握の内容
⑤
核酸等を用いる場合に記載及び添付が必要な事項(核酸等を用いる場合に限る。)
「核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提
供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必
要な事項について」
(令和7年5月 30 日付け医政研発 0530 第5号厚生労働省医政
局研究開発政策課長通知)に基づく記載事項について記載するとともに必要な書
類を添付すること。
(3) 実施責任者及び再生医療等を行う医師又は歯科医師の氏名、所属、役職及び略歴(再