よむ、つかう、まなぶ。
再生医療等提供計画等の記載要領等について[2.0MB] (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
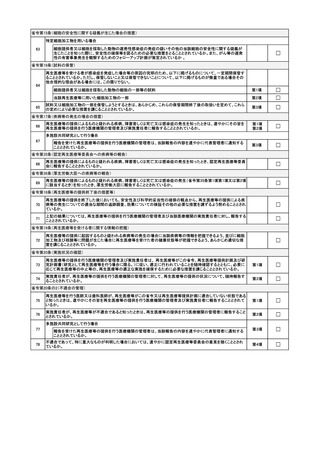
省令第104条(変更の管理)
製造手順等について、特定細胞加工物等の品質に影響を及ぼすおそれのある変更を行う場合
変更の記録及び品質部門による当該変更の承認の記録を作成・保存することとしているか。
第1項
第2項
☐
☐
当該特定細胞加工物等製造事業者が製造した特定細胞加工物等の提供先の再生医療等提供機関に報告すること
としているか。
第3項
☐
第1項第1号
☐
☐
変更の管理に関する手順書等に基づき、適切な対応をとることとしているか。
126
省令第105条(逸脱の管理)
製造手順等からの逸脱が生じた場合
127
逸脱の管理に関する手順書等に基づき、適切な対応をとることとしているか。
逸脱の内容を記録することとしているか。
重大な逸脱が生じた場合
128
逸脱による特定細胞加工物等の品質への影響を評価し、所要の措置をとることをしているか。
第1項第2号
上記の評価及び措置についての記録及び品質部門による確認の記録を作成・保管することとしているか。
第1項第2号
第2項
☐
☐
第3項
☐
当該特定細胞加工物等製造事業者が製造した特定細胞加工物の提供先の再生医療等提供機関に報告することと
しているか。
省令第106条(品質等に関する情報及び品質不良等の処理)
特定細胞加工物等に係る品質等に関する情報を得た場合
☐
品質情報及び品質不良等の処理に関する手順書等に基づき、適切な対応をとることとしているか。
129
当該品質情報に係る事項の原因を究明し、製造管理又は品質管理に関し改善が必要な場合に必要な措置を採るこ
とととしているか。
上記の当該品質情報の内容、原因究明の結果及び改善措置を作成・保管し、品質部門による確認を受けている
か。
品質不良又はそのおそれが判明した場合、当該特定細胞加工物等製造事業者が製造した特定細胞加工物等の提
供先の再生医療等提供機関に報告することとしているか。
第1項
☐
第1項
☐
第3項
☐
必要な措置等を講ずることとしているか。
第1項
☐
☐
速やかに当該特定細胞加工物等製造事業者が製造した特定細胞加工物等の提供先の再生医療等提供機関に報
告することとしているか。
第1項
☐
速やかに厚生労働大臣に報告することとしているか。
第1項
☐
当該措置に係る特定細胞加工物等を保管する場合、当該特定細胞加工物等を区分して一定期間保管した後、適切
に処理することとしているか。
第2項
☐
☐
☐
☐
省令第107条(重大事態報告等)
特定細胞加工物等の安全性の確保に重大な影響を及ぼすおそれがある事態が生じた場合
130
省令第108条(自己点検)
131
自己点検に関する手順書等に基づき、定期的な自己点検等の業務を適切に行うこととしているか。
第1項
132
自己点検の結果、改善が必要な場合に所要の措置を採ることとしているか。
第1項
133
自己点検の結果及び必要な改善のための措置の記録を作成・保管することとしているか。
第1項
第2項
省令第109条(教育訓練)
教育訓練に関する手順書等に基づき、製造管理及び品質管理等に関して以下に掲げる必要な教育訓練を行うこととして
いるか。
134
135
第1号
製造・品質管理業務に従事する職員に対する製造管理及び品質管理に関する教育訓練
第1号
製造又は試験検査に従事する職員に対する衛生管理、微生物学、医学その他必要な教育訓練
第2号
☐
☐
清浄度管理区域・無菌操作等区域等での作業に従事する職員並びに特定細胞加工物等の製造に使用する人/動
物の細胞又は微生物等の培養その他の加工等に係る作業に従事する職員に対する微生物等による汚染防止に必
要な措置に関する教育訓練
第3号
☐
第5号
☐
文書及び記録の管理に関する手順書等に基づき、文書の承認、配付、保管等の業務を適切に行うこととしているか。
第1号
☐
上記の記録について、次に掲げる期間保存することとしているか。
第3号
教育訓練の実施の記録を作成・保管することとしているか。
省令第110条(文書及び記録の管理)
136
131
特定生物由来製品該当医薬品又は指定再生医療等製品の原料と類似の原料からなる特定細胞加工物等:提供日
から起算して少なくとも30年間
第3号イ
☐
上記以外の特定細胞加工物等:少なくとも10年間
第3号ロ
☐
[用いた略語] 法:再生医療等の安全性の確保等に関する法律(平成25年法律第85号)
省令:再生医療等の安全性の確保等に関する法律施行規則(平成26年厚生労働省令第110号)
カルタヘナ法:遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成15年法律第97号)
製造手順等について、特定細胞加工物等の品質に影響を及ぼすおそれのある変更を行う場合
変更の記録及び品質部門による当該変更の承認の記録を作成・保存することとしているか。
第1項
第2項
☐
☐
当該特定細胞加工物等製造事業者が製造した特定細胞加工物等の提供先の再生医療等提供機関に報告すること
としているか。
第3項
☐
第1項第1号
☐
☐
変更の管理に関する手順書等に基づき、適切な対応をとることとしているか。
126
省令第105条(逸脱の管理)
製造手順等からの逸脱が生じた場合
127
逸脱の管理に関する手順書等に基づき、適切な対応をとることとしているか。
逸脱の内容を記録することとしているか。
重大な逸脱が生じた場合
128
逸脱による特定細胞加工物等の品質への影響を評価し、所要の措置をとることをしているか。
第1項第2号
上記の評価及び措置についての記録及び品質部門による確認の記録を作成・保管することとしているか。
第1項第2号
第2項
☐
☐
第3項
☐
当該特定細胞加工物等製造事業者が製造した特定細胞加工物の提供先の再生医療等提供機関に報告することと
しているか。
省令第106条(品質等に関する情報及び品質不良等の処理)
特定細胞加工物等に係る品質等に関する情報を得た場合
☐
品質情報及び品質不良等の処理に関する手順書等に基づき、適切な対応をとることとしているか。
129
当該品質情報に係る事項の原因を究明し、製造管理又は品質管理に関し改善が必要な場合に必要な措置を採るこ
とととしているか。
上記の当該品質情報の内容、原因究明の結果及び改善措置を作成・保管し、品質部門による確認を受けている
か。
品質不良又はそのおそれが判明した場合、当該特定細胞加工物等製造事業者が製造した特定細胞加工物等の提
供先の再生医療等提供機関に報告することとしているか。
第1項
☐
第1項
☐
第3項
☐
必要な措置等を講ずることとしているか。
第1項
☐
☐
速やかに当該特定細胞加工物等製造事業者が製造した特定細胞加工物等の提供先の再生医療等提供機関に報
告することとしているか。
第1項
☐
速やかに厚生労働大臣に報告することとしているか。
第1項
☐
当該措置に係る特定細胞加工物等を保管する場合、当該特定細胞加工物等を区分して一定期間保管した後、適切
に処理することとしているか。
第2項
☐
☐
☐
☐
省令第107条(重大事態報告等)
特定細胞加工物等の安全性の確保に重大な影響を及ぼすおそれがある事態が生じた場合
130
省令第108条(自己点検)
131
自己点検に関する手順書等に基づき、定期的な自己点検等の業務を適切に行うこととしているか。
第1項
132
自己点検の結果、改善が必要な場合に所要の措置を採ることとしているか。
第1項
133
自己点検の結果及び必要な改善のための措置の記録を作成・保管することとしているか。
第1項
第2項
省令第109条(教育訓練)
教育訓練に関する手順書等に基づき、製造管理及び品質管理等に関して以下に掲げる必要な教育訓練を行うこととして
いるか。
134
135
第1号
製造・品質管理業務に従事する職員に対する製造管理及び品質管理に関する教育訓練
第1号
製造又は試験検査に従事する職員に対する衛生管理、微生物学、医学その他必要な教育訓練
第2号
☐
☐
清浄度管理区域・無菌操作等区域等での作業に従事する職員並びに特定細胞加工物等の製造に使用する人/動
物の細胞又は微生物等の培養その他の加工等に係る作業に従事する職員に対する微生物等による汚染防止に必
要な措置に関する教育訓練
第3号
☐
第5号
☐
文書及び記録の管理に関する手順書等に基づき、文書の承認、配付、保管等の業務を適切に行うこととしているか。
第1号
☐
上記の記録について、次に掲げる期間保存することとしているか。
第3号
教育訓練の実施の記録を作成・保管することとしているか。
省令第110条(文書及び記録の管理)
136
131
特定生物由来製品該当医薬品又は指定再生医療等製品の原料と類似の原料からなる特定細胞加工物等:提供日
から起算して少なくとも30年間
第3号イ
☐
上記以外の特定細胞加工物等:少なくとも10年間
第3号ロ
☐
[用いた略語] 法:再生医療等の安全性の確保等に関する法律(平成25年法律第85号)
省令:再生医療等の安全性の確保等に関する法律施行規則(平成26年厚生労働省令第110号)
カルタヘナ法:遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成15年法律第97号)