【資料No.1】2.5_臨床に関する概括資料 (52 ページ)
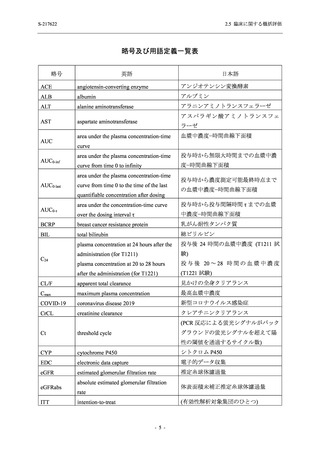
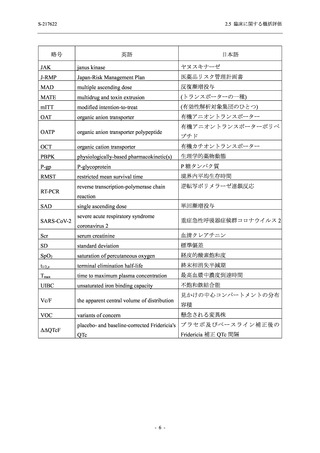
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
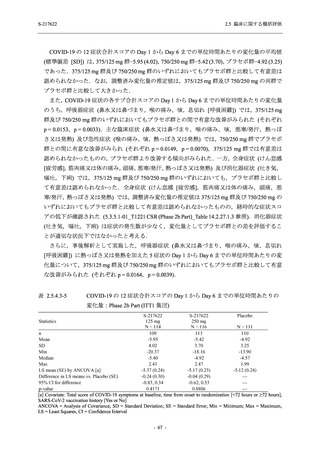
2.5.4
2.5 臨床に関する概括評価
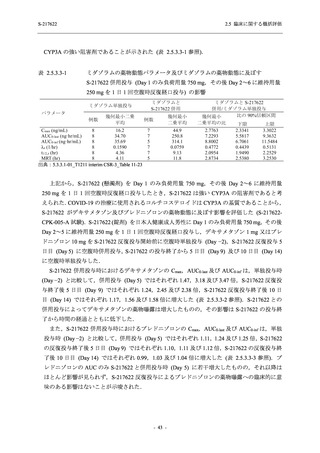
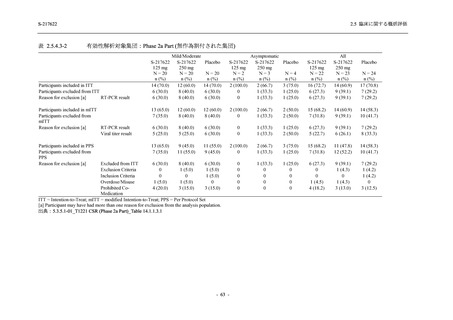
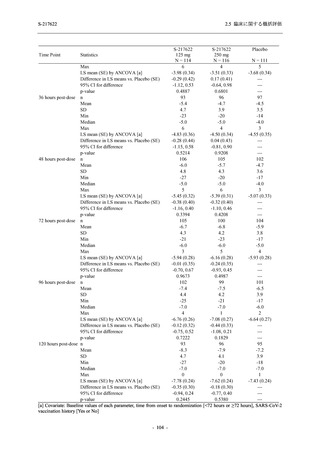
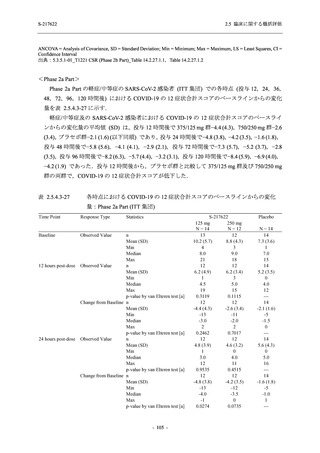
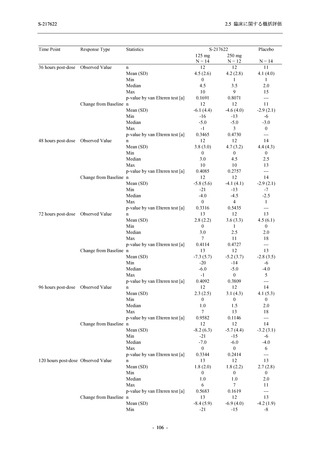
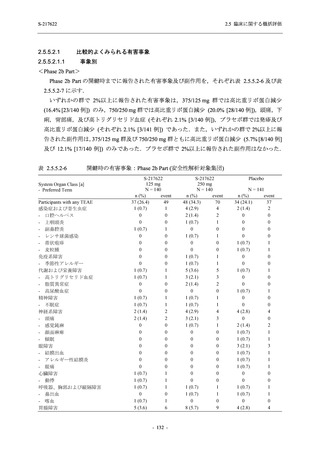
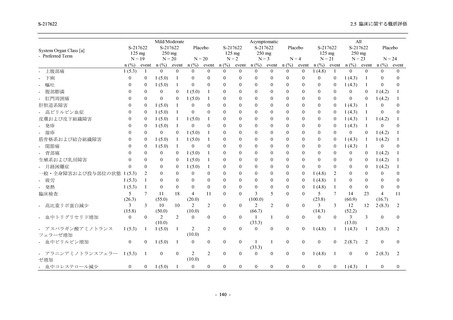
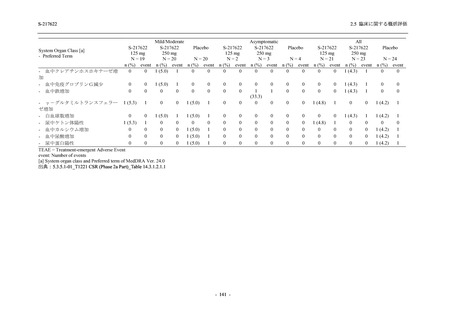
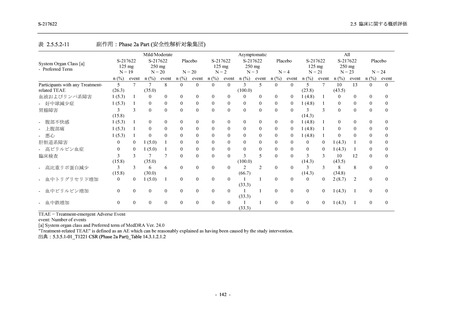
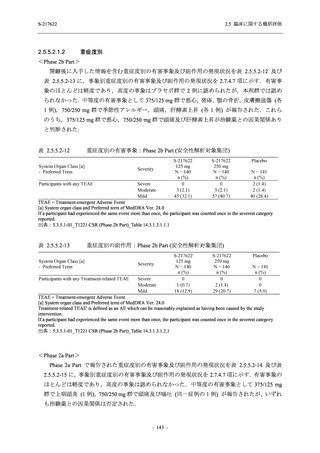
有効性の概括評価
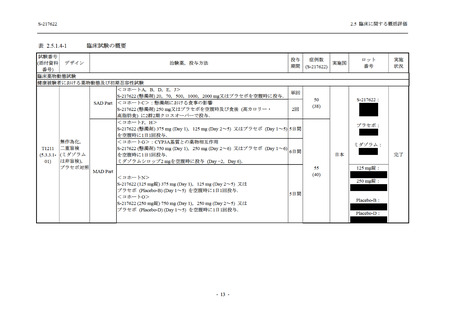
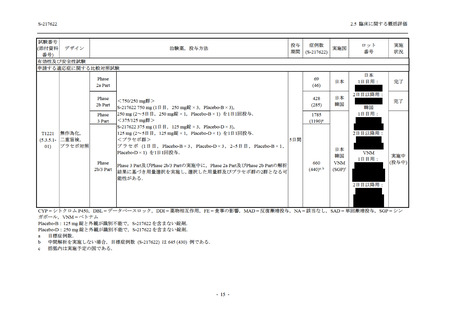
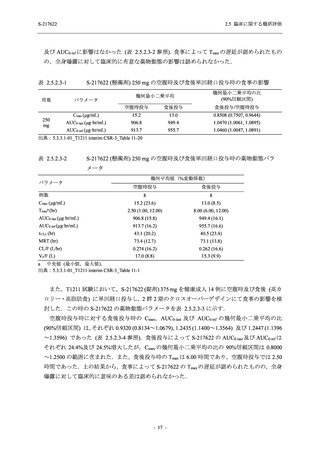
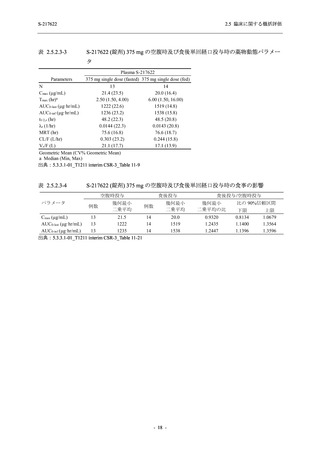
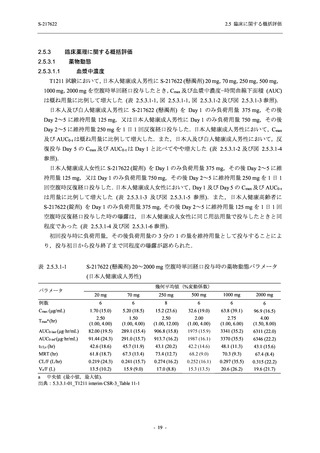
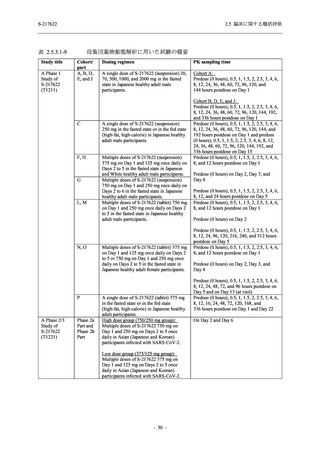
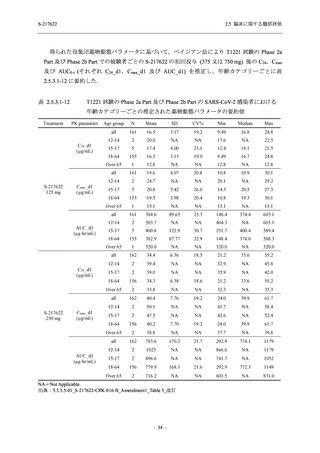
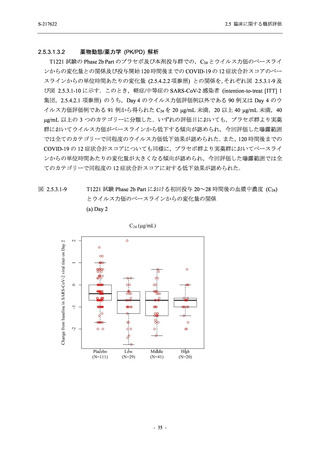
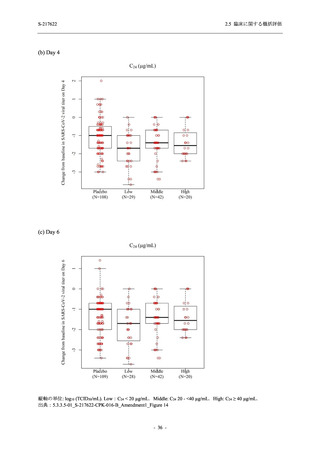
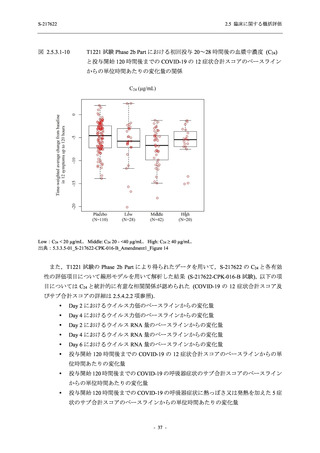
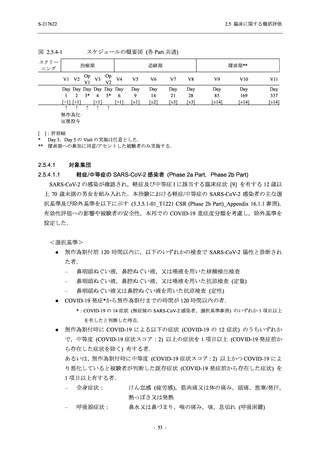
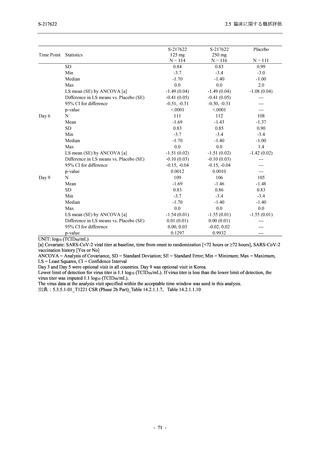
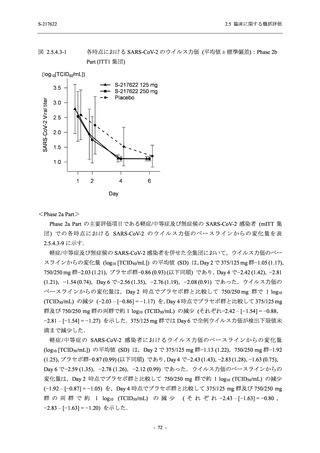
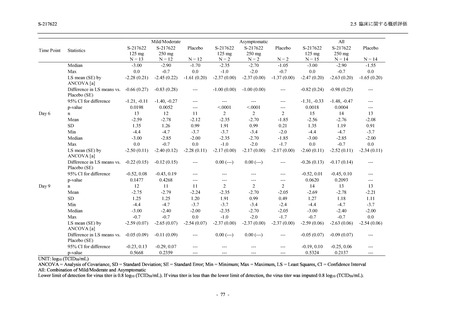
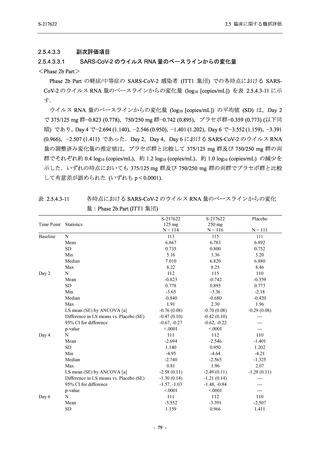
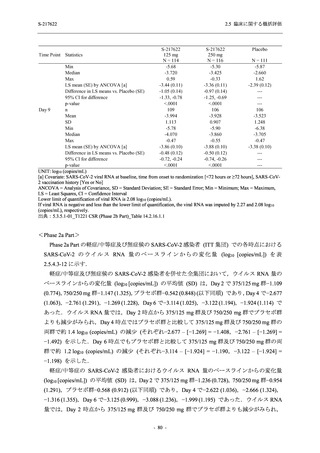
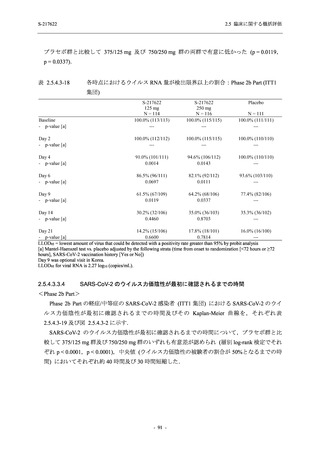
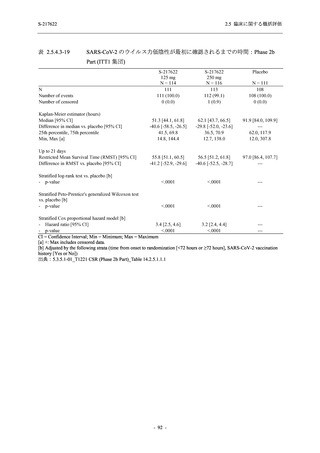
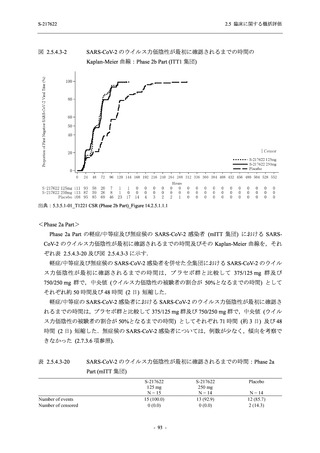
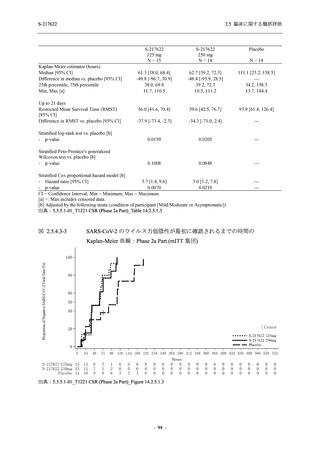
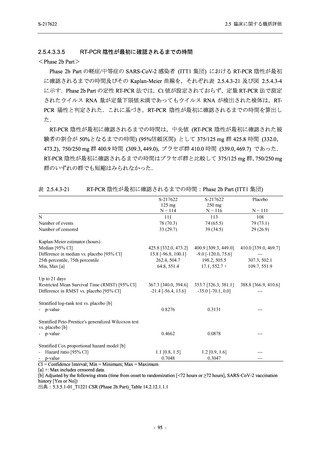
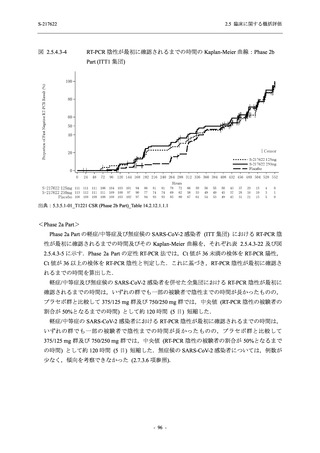
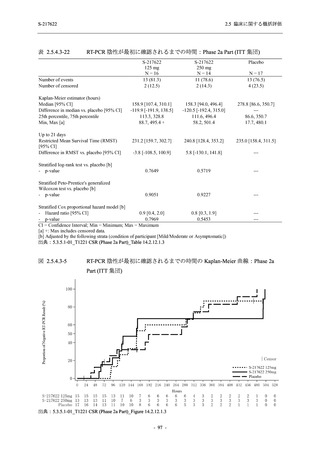
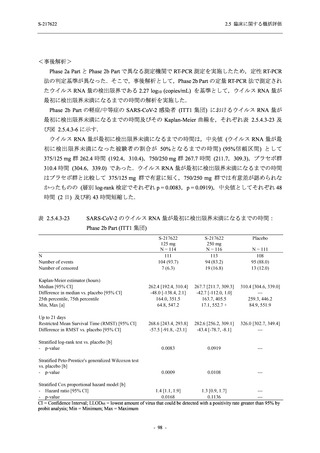
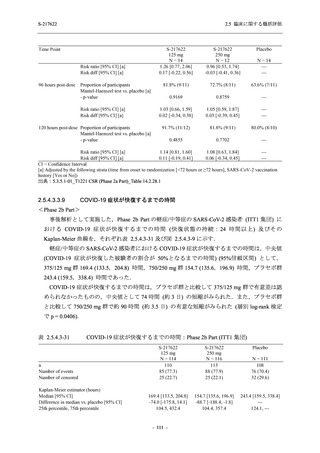
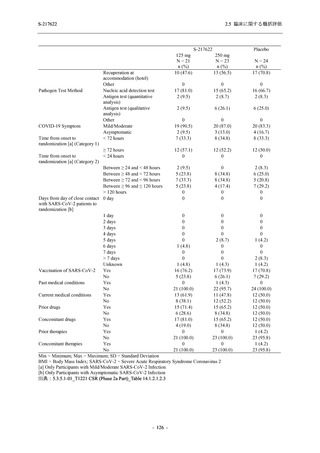
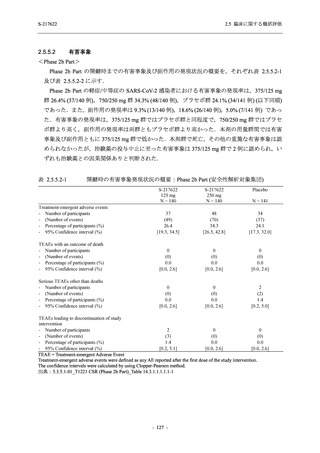
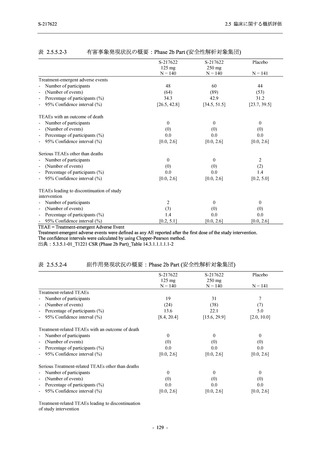
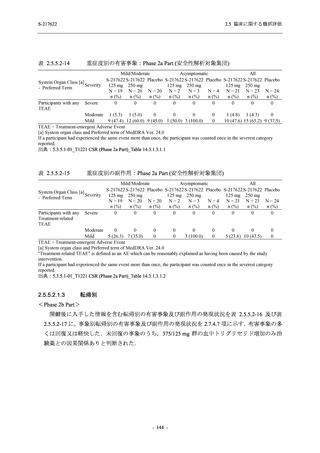
軽症/中等症及び無症候の SARS-CoV-2 感染者に対する本剤の有効性を,T1221 試験 Phase 2b
Part 及び Phase 2a Part のデータを用いて評価した.
T1221 試験は多施設共同,無作為化,二重盲検,プラセボ対照試験であり,軽症/中等症又は
無症候の SARS-CoV-2 感染者を対象に抗ウイルス効果を探索的に確認する Phase 2a Part,軽症/
中等症の SARS-CoV-2 感染者を対象に早期の臨床症状改善効果及び SARS-CoV-2 に対する抗ウ
イルス効果を確認する Phase 2b Part,軽症/中等症の SARS-CoV-2 感染者を対象に有効性を検証
する Phase 3 Part,及び無症候/軽度症状のみ有する SARS-CoV-2 感染者を対象に有効性を検証す
る Phase 2b/3 Part の 4 つの Part で構成された.
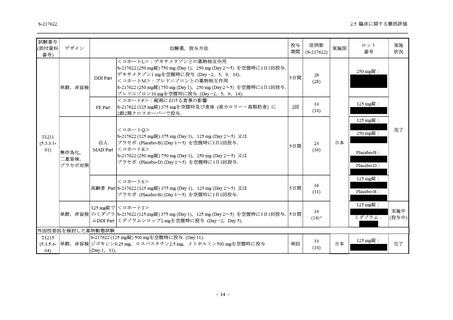
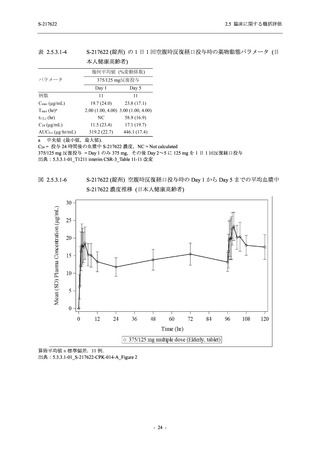
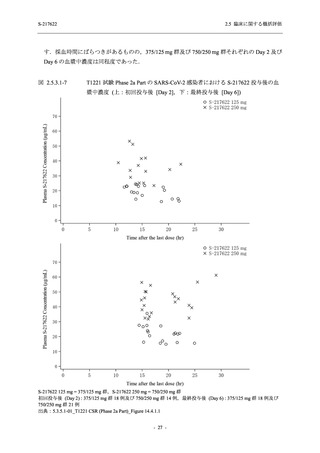
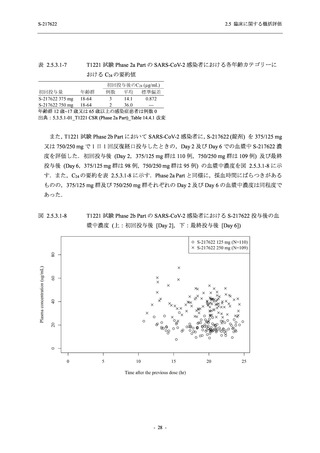
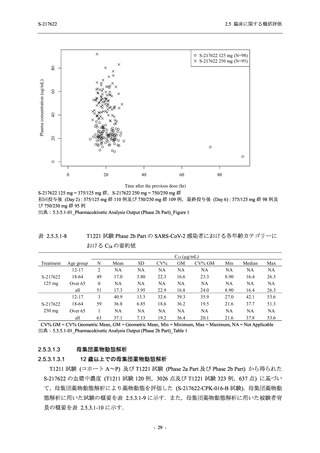
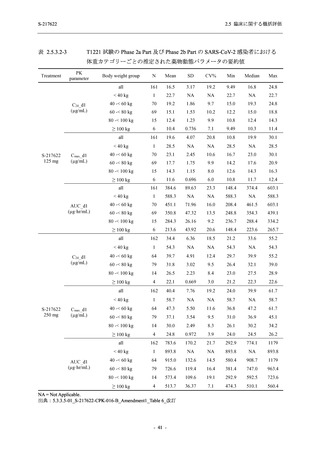
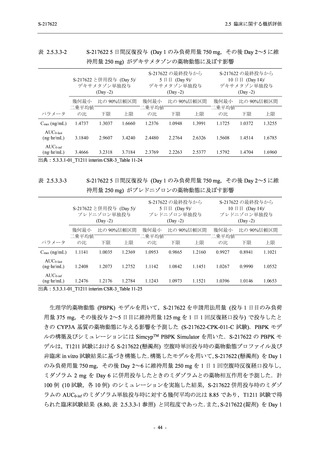
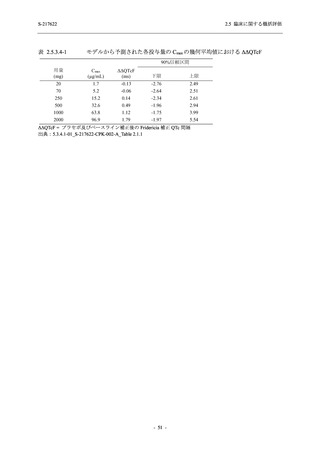
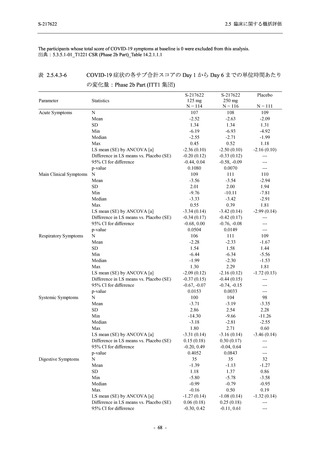
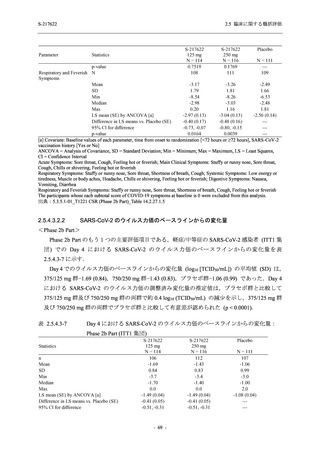
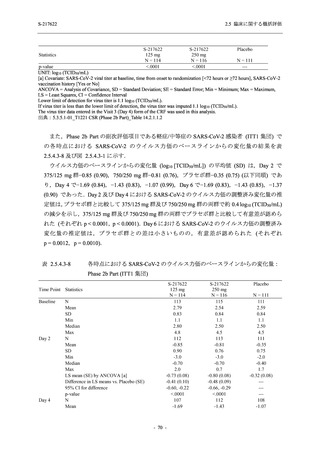
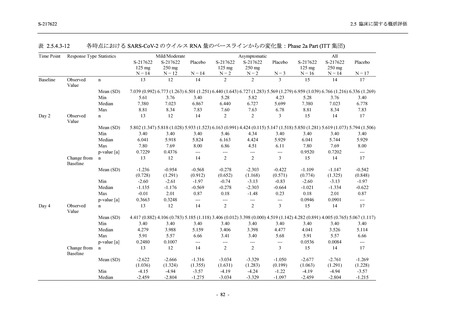
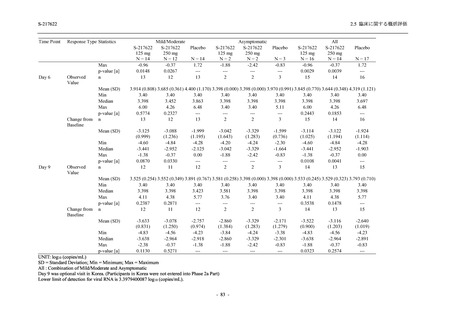
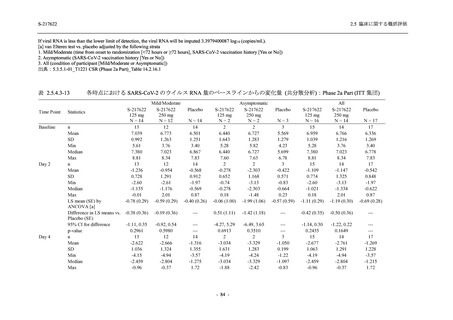
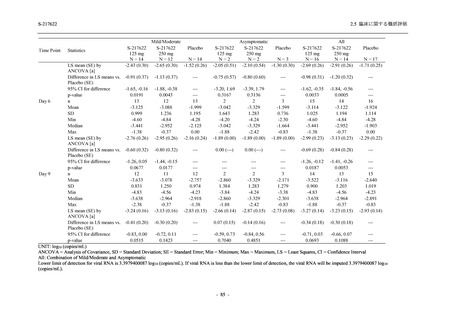
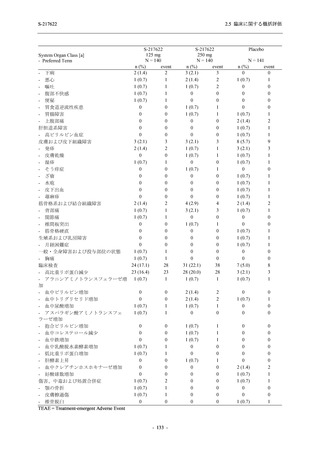
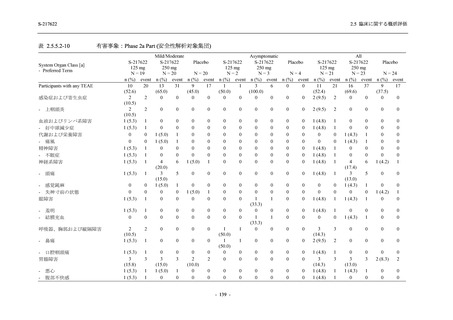
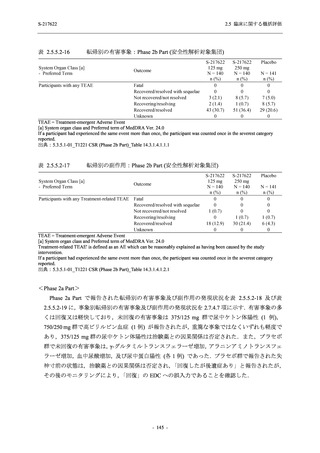
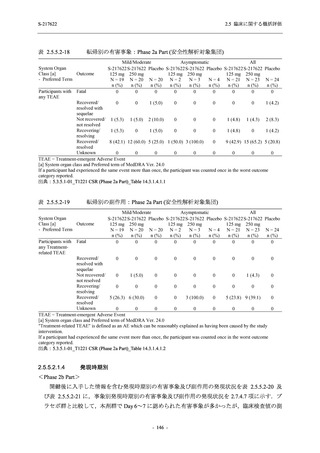
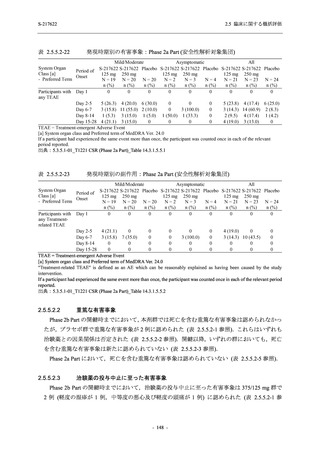
Phase 2b Part では軽症/中等症の SARS-CoV-2 感染者を,Phase 2a Part では軽症/中等症及び無
症候の SARS-CoV-2 感染者を 375/125 mg 群,750/250 mg 群,プラセボ群の 3 群に 1:1:1 の比
率で無作為に割付けた.各投与群の用法用量を以下に示す.各被験者の治験期間は 28 日間とし,
Phase 2b Part では 6 日間の有効性及び安全性を評価し,21 日間の有効性及び 28 日間の安全性も
確認した.
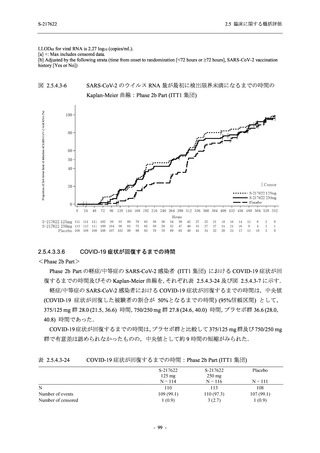
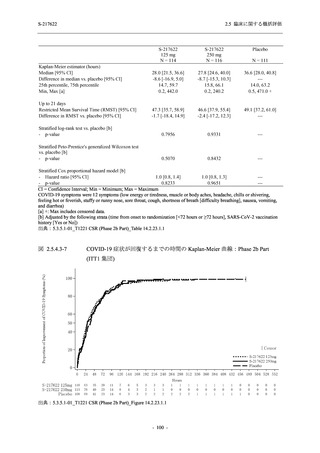
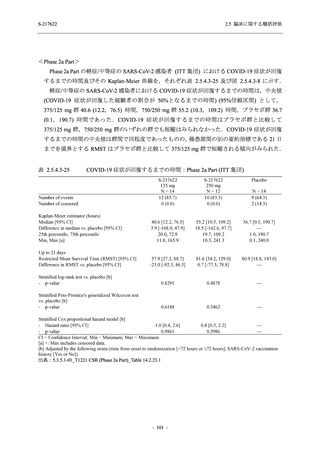
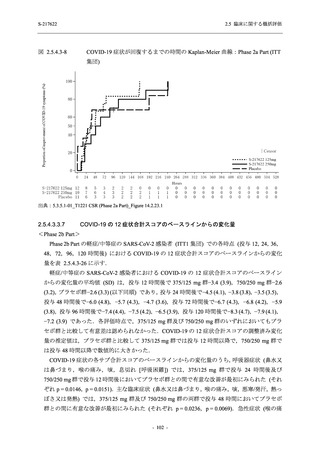
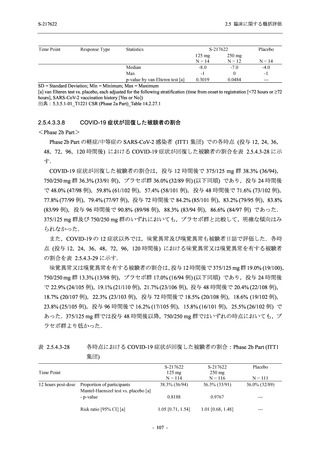
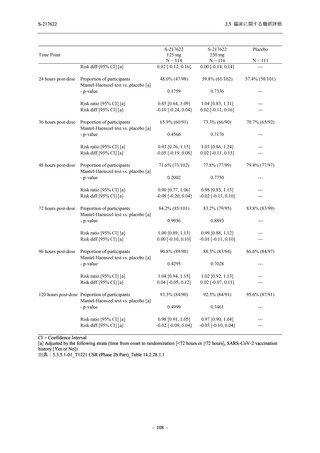
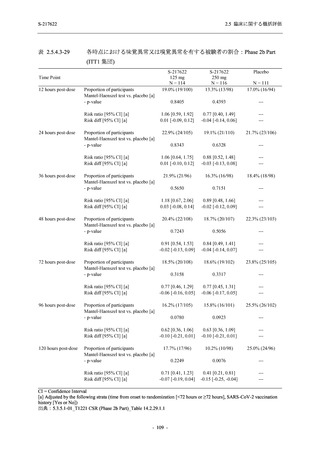
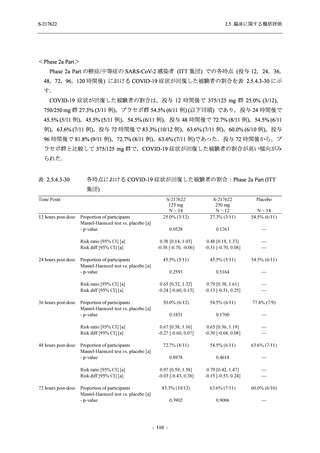
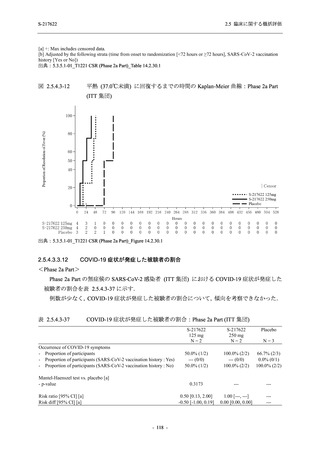
Phase 2a Part では 21 日間の有効性及び 28 日間の安全性を評価した (図 2.5.4-1 参照).
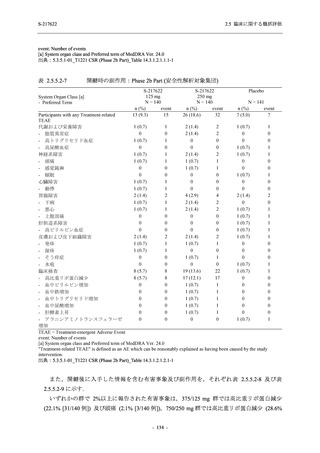
●
375/125 mg 群 (表中では「125 mg」と示す):
1 日 1 回 5 日間,以下の用量を経口投与した.
1 日目に 125 mg 錠 × 3 錠及び Placebo-D × 3 錠,2 日目から 5 日目に 125 mg 錠 × 1 錠及
び Placebo-D × 1 錠を投与.
●
750/250 mg 群 (表中では「250 mg」と示す):
1 日 1 回 5 日間,以下の用量を経口投与した.
1 日目に 250 mg 錠 × 3 錠及び Placebo-B × 3 錠,2 日目から 5 日目に 250 mg 錠 × 1 錠及
び Placebo-B × 1 錠を投与.
●
プラセボ群:
1 日 1 回 5 日間,以下の用量を経口投与した.
1 日目に Placebo-B × 3 錠及び Placebo-D × 3 錠,2 日目から 5 日目に Placebo-B × 1 錠及
び Placebo-D × 1 錠を投与.
- 52 -