【資料No.1】2.5_臨床に関する概括資料 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5 臨床に関する概括評価
また,2022 年 2 月現在,本邦におけるワクチン 2 回接種完了率は 78%以上に到るが [23],ワ
クチン接種からの時間経過による中和抗体の減少や,感染力の高い変異株出現によるブレイク
スルー感染が懸念されており,3 回目接種が進められている.COVID-19 の収束まで,このよう
な状況が続くと予想され,感染予防の継続に加え,変異株を含めた SARS-CoV-2 に有効な治療
薬の開発が強く望まれている.
これらのことから,これまでの日常生活を取り戻す上で,COVID-19 の収束は極めて重要であ
る.SARS-CoV-2 の感染拡大を抑制するため,感染初期の患者に対して治療機会を広く提供する
ために,重症化リスクを有しない軽症又は無症候の患者も対象とする,自宅で簡便に服薬可能
な経口の抗ウイルス薬開発の必要性は,非常に高いと考えられる.
2.5.1.3
臨床開発計画
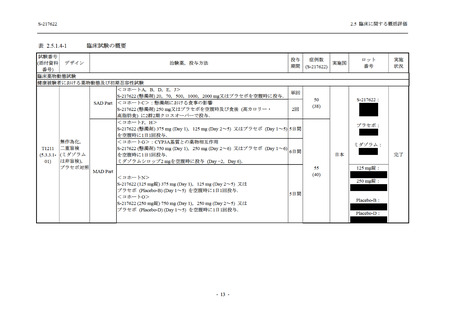
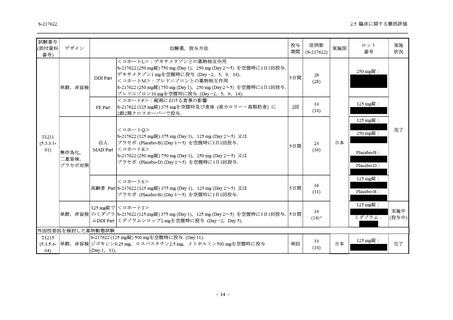
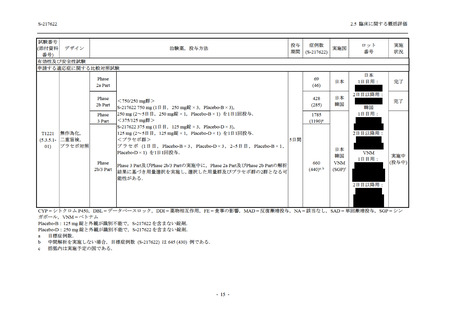
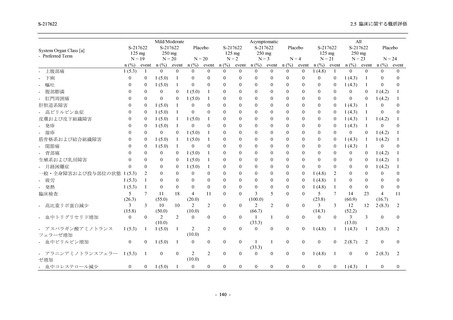
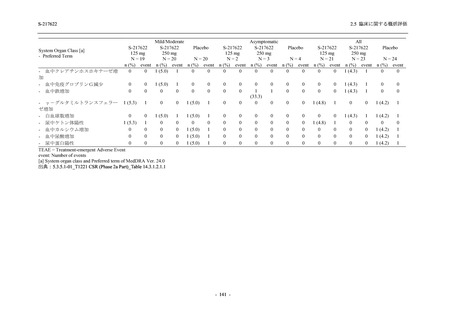
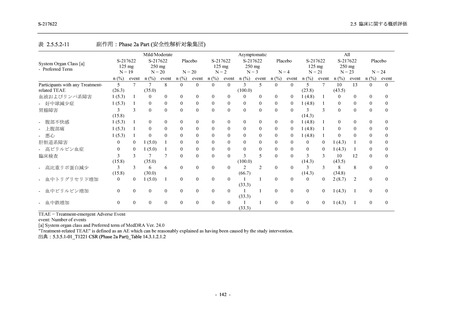
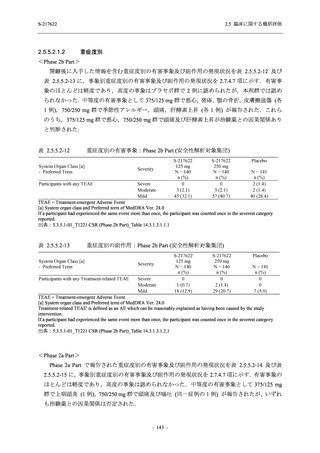
S-217622 は,SARS-CoV-2 感染マウスモデルにおいて用量依存的な肺内ウイルス力価の低下
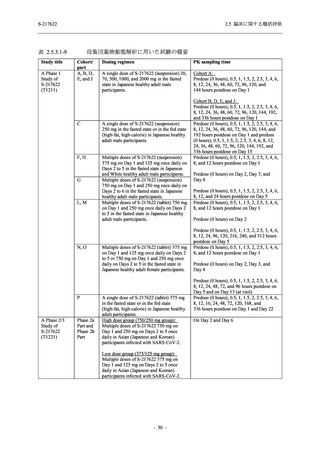
が確認され (2.4.2.1.3 項参照),2021 年 7 月から臨床試験を開始した.2022 年 6 月 7 日現在,本
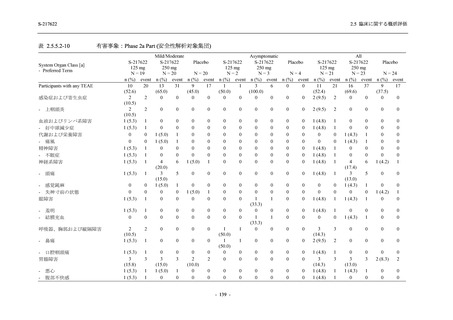
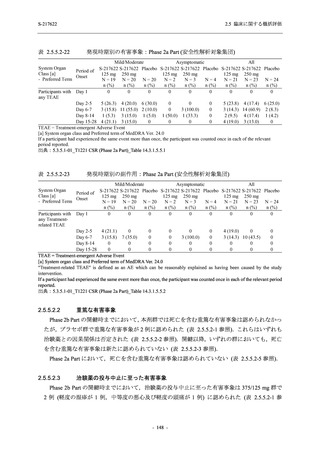
剤の開発パッケージの一環として,第 1 相試験を 1 試験完了し,第 1 相試験及び第 2/3 相試験
を各 1 試験実施している (表 2.5.1.4-1 参照).なお,本剤の開発及び臨床試験は,医薬品医療機
器総合機構との事前面談において,相談及び協議の上,計画実施した.
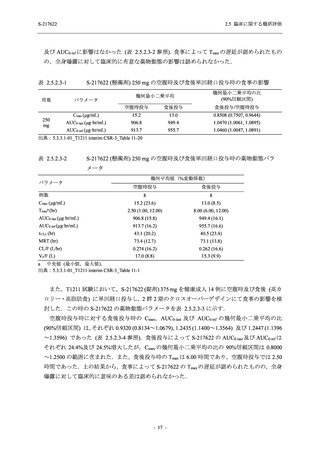
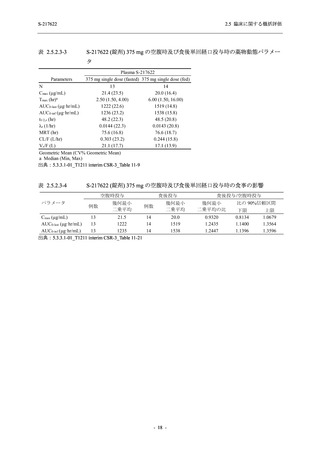
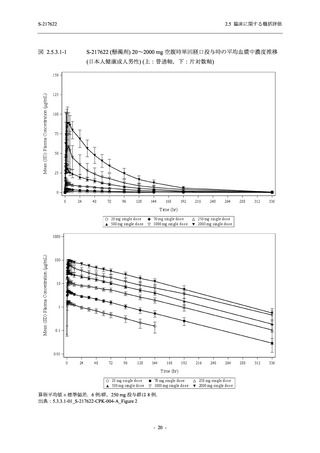
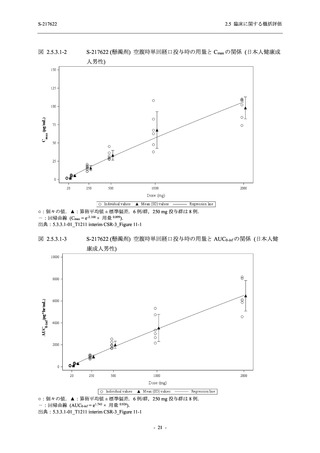
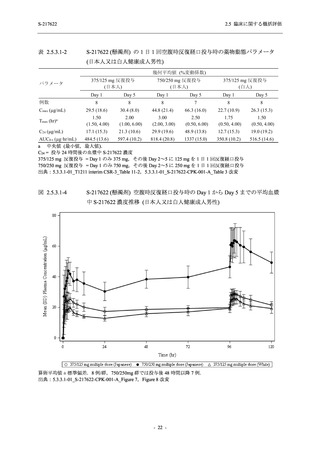
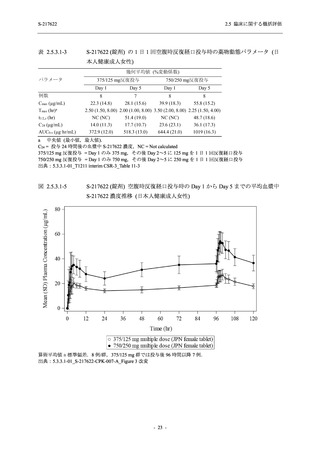
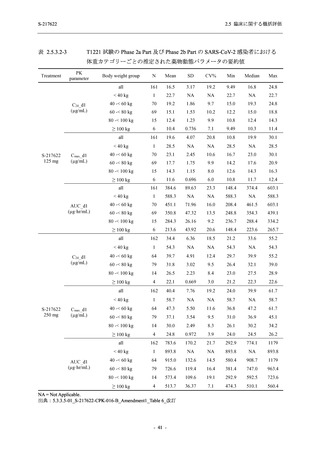
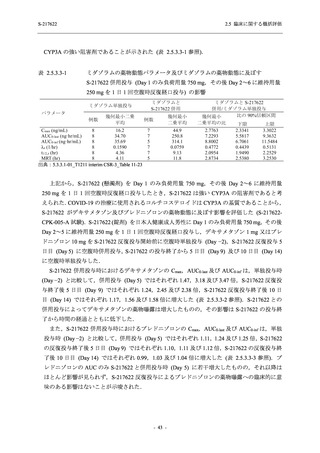
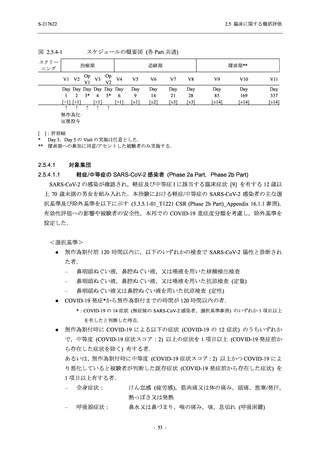
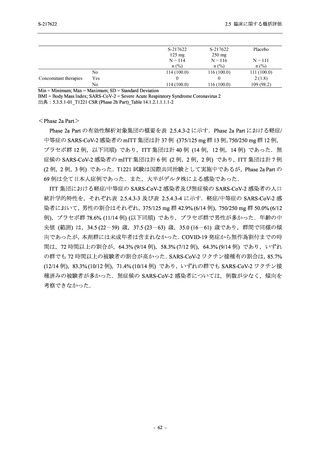
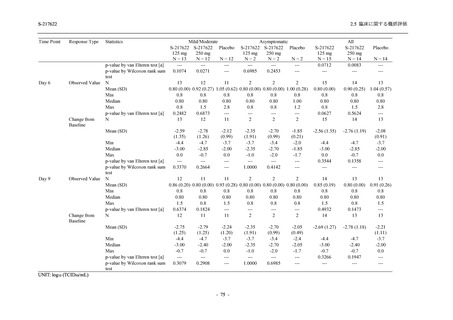
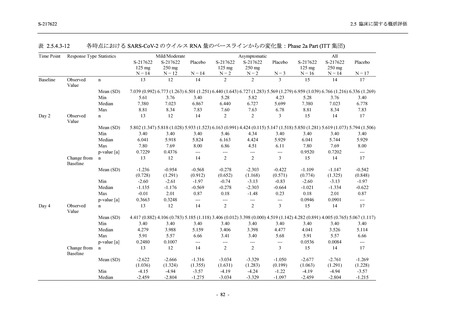
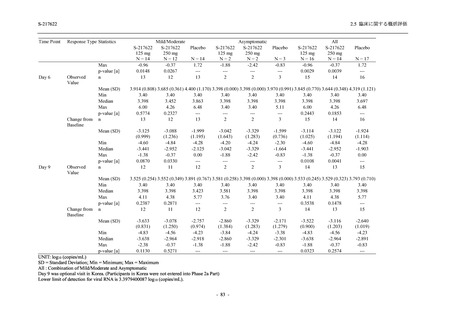
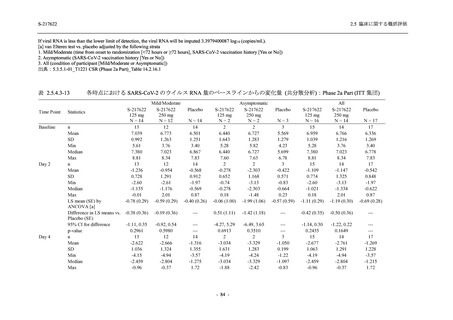
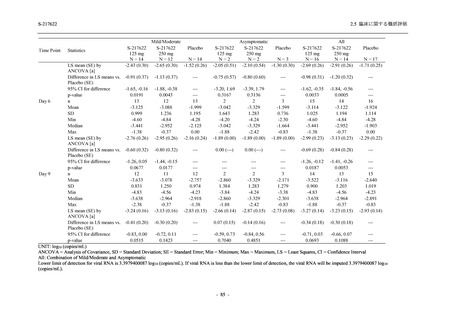
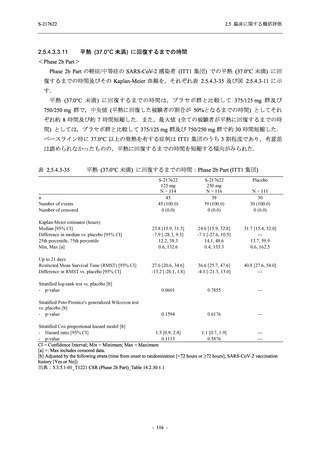
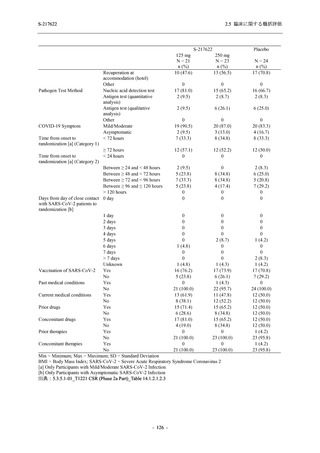
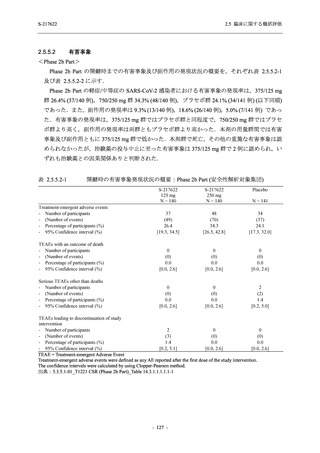
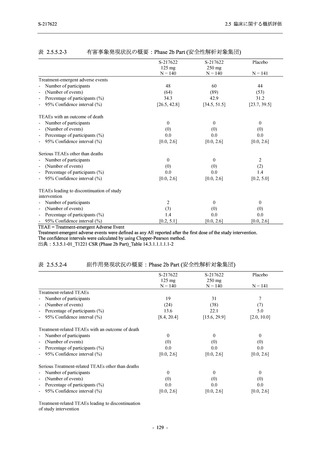
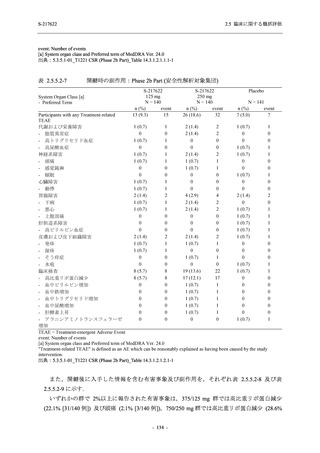
2021 年 7 月から開始した健康成人対象第 1 相試験 (以下,T1211 試験) において,本剤の懸
濁剤を用いた単回漸増投与,1 日 1 回 5 日間の反復漸増投与を行い,評価した用量までの健康
成人における安全性及び忍容性を確認した (5.3.3.1-01 参照).その後,2021 年 9 月から
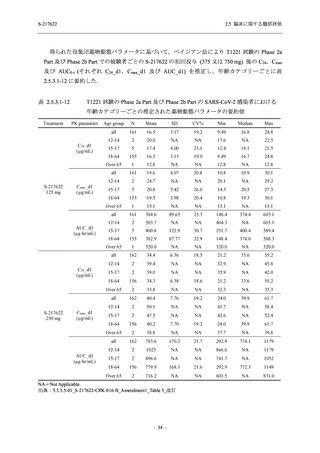
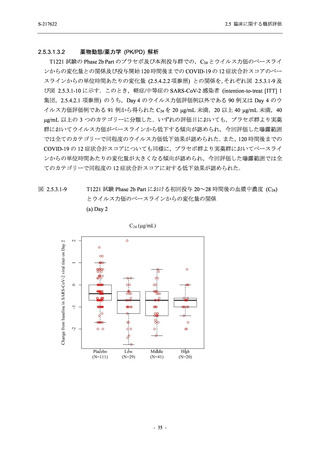
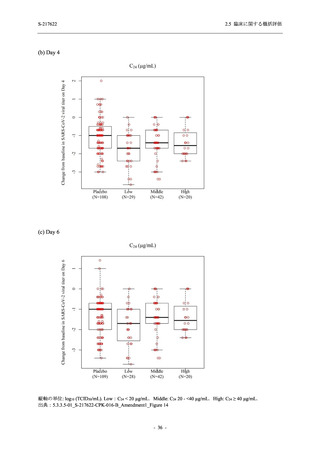
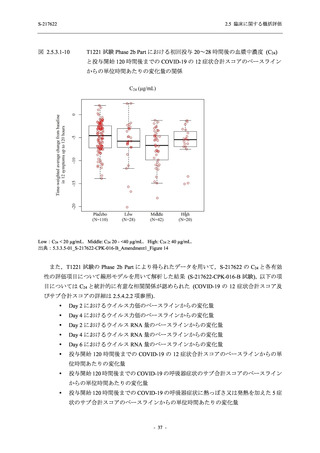
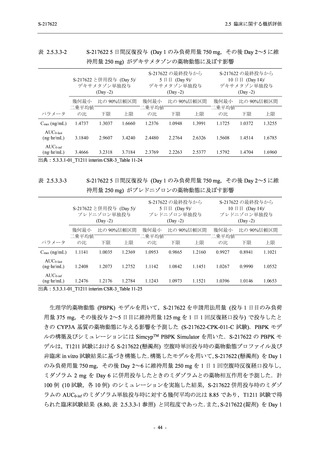
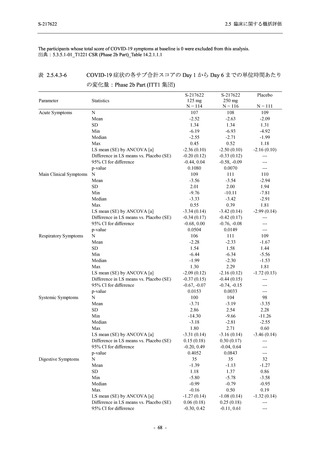
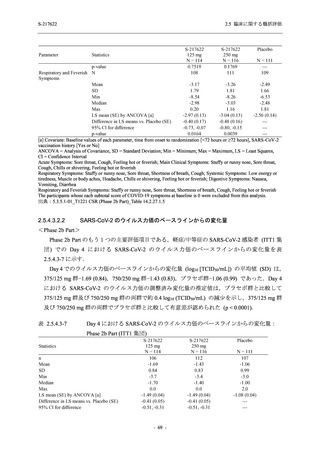
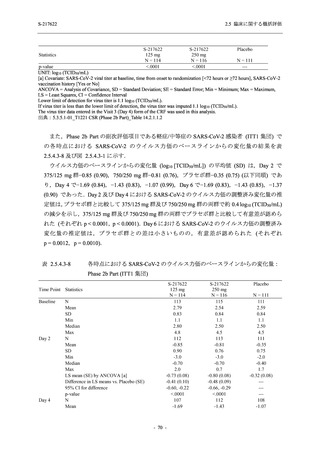
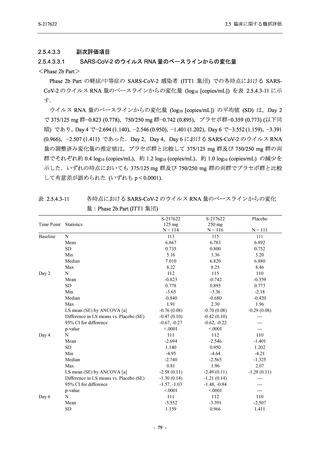
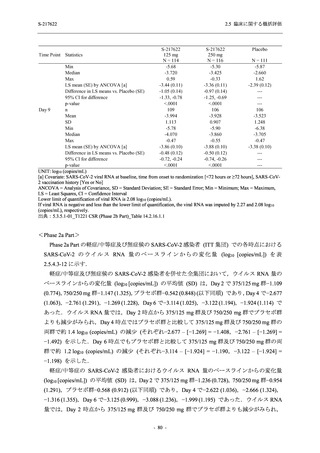
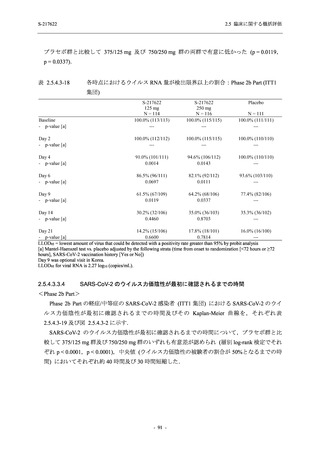
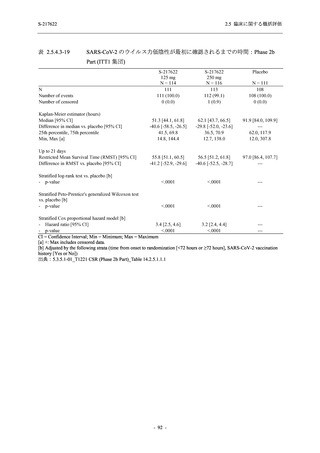
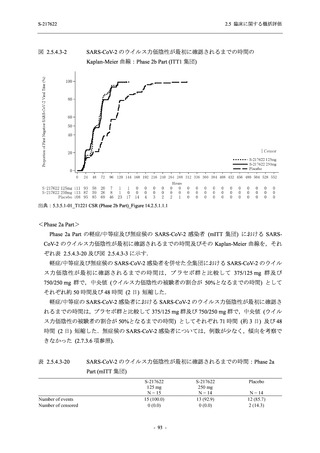
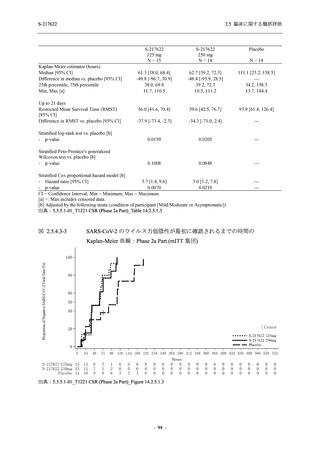
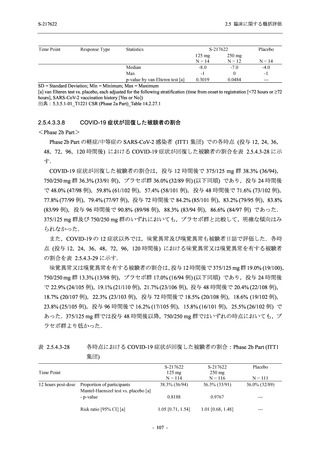
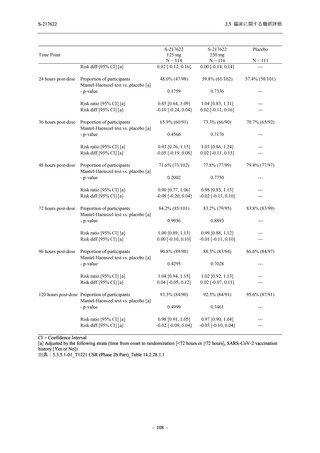
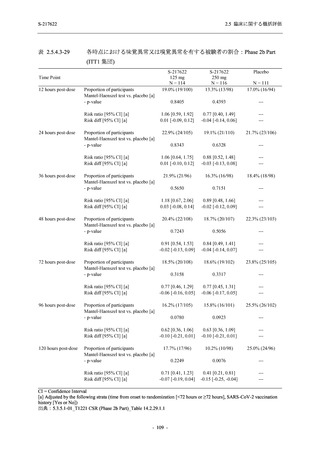
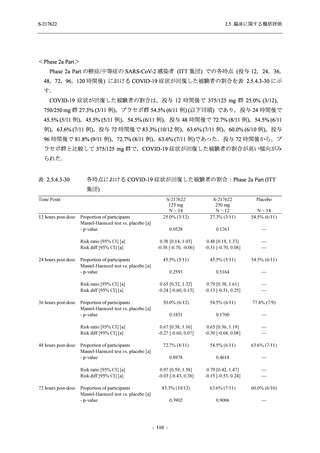
SARS-CoV-2 感染者対象第 2/3 相試験 (以下,T1221 試験) を開始した.T1221 試験は無症候か
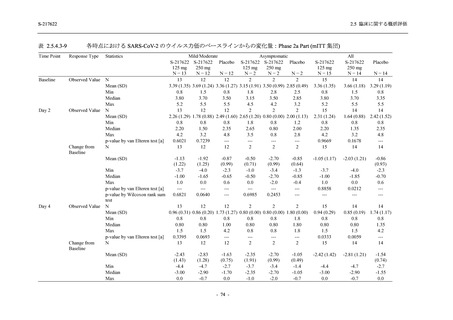
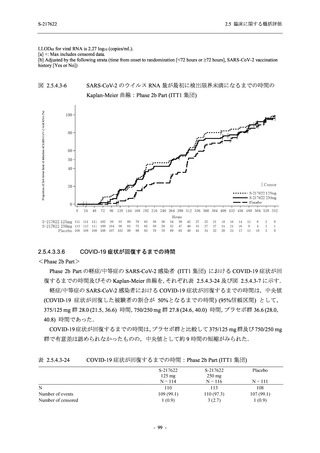
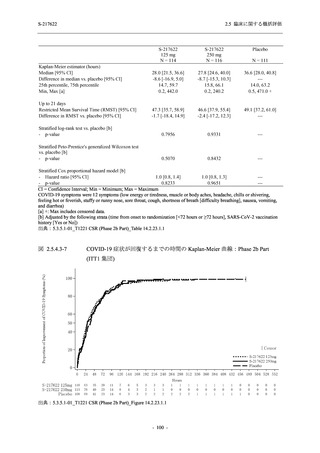
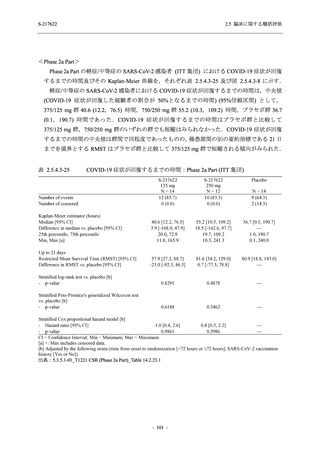
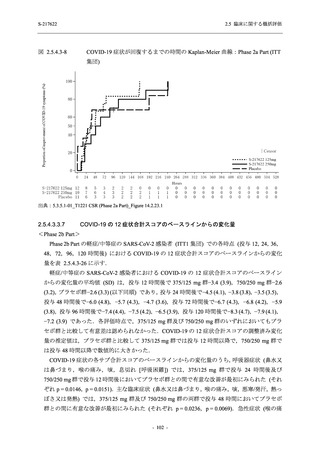
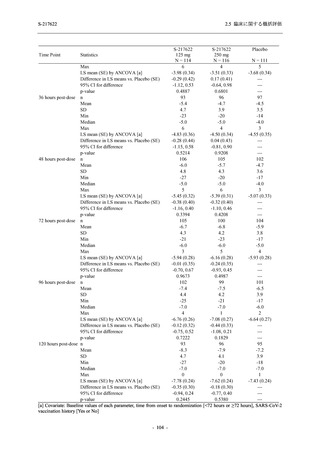
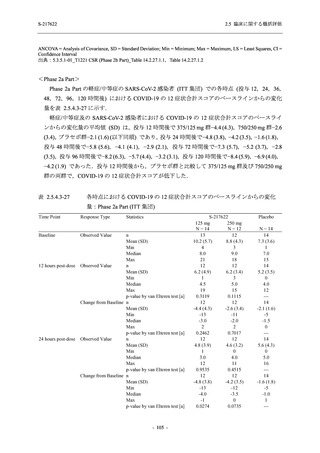
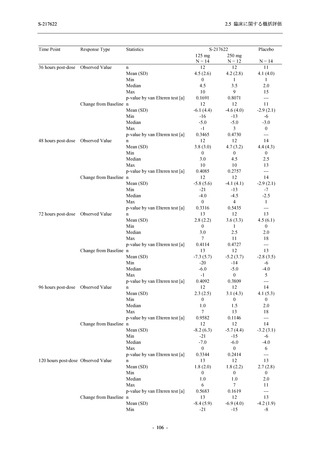
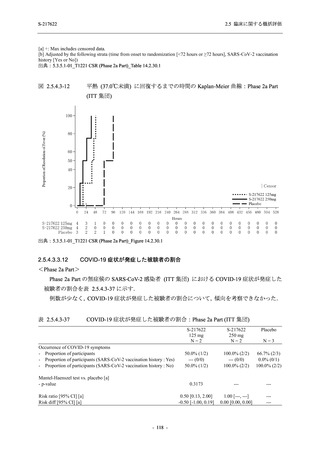
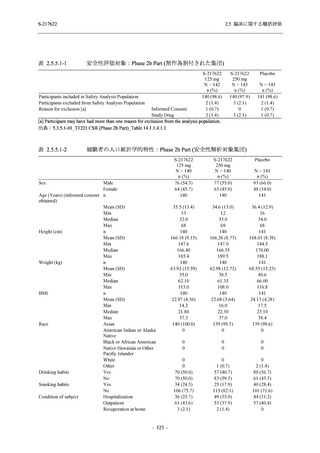
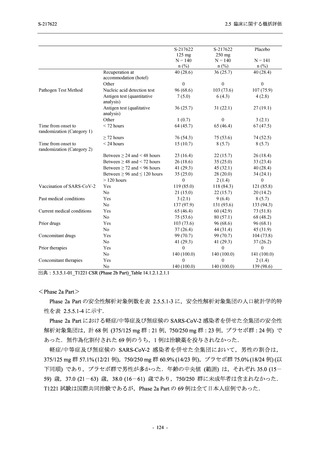
ら中等症の感染者を対象とした第 2/3 相試験として計画し,その内の Phase 2a Part では本剤の
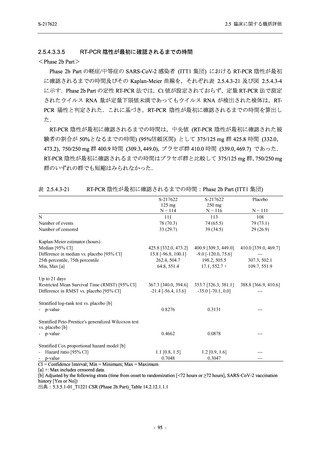
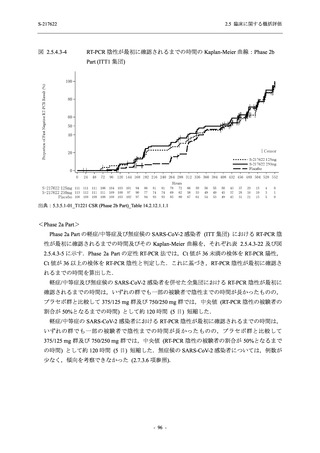
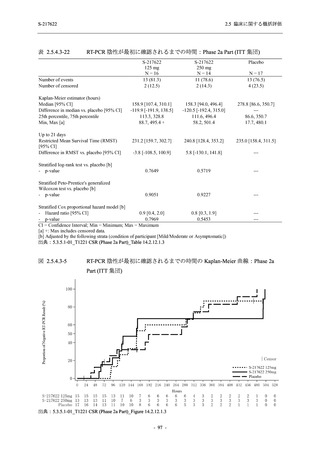
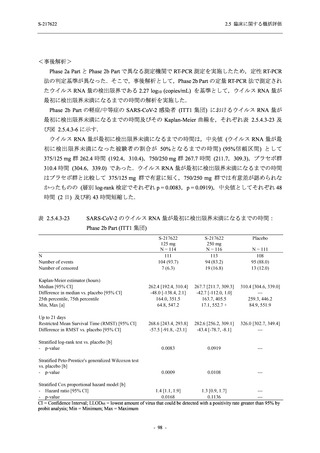
抗ウイルス効果を探索的に評価すること,Phase 2b Part では本剤の早期の臨床症状改善効果及
び抗ウイルス効果を確認すること,Phase 3 Part 及び Phase 2b/3 Part では本剤の有効性を検証す
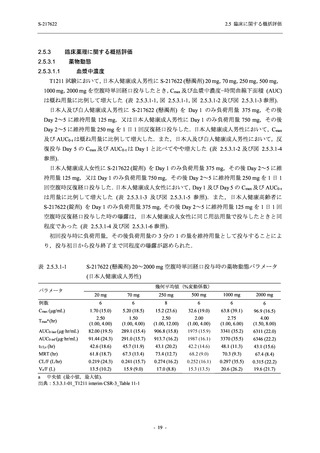
ることを主目的とした.また,健康成人対象第 1 相薬物相互作用試験 (以下,T1215 試験) では,
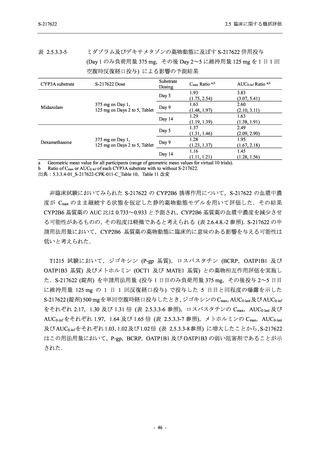
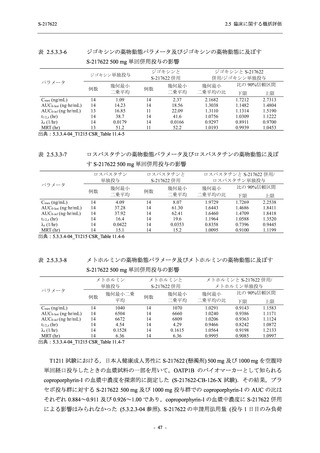
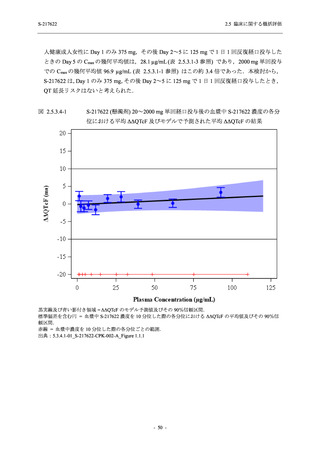
ジゴキシン (P 糖タンパク質 [P-gp] 基質),ロスバスタチン (乳がん耐性タンパク質 [BCRP],
有機アニオントランスポーターポリペプチド [OATP] 1B1 及び OATP1B3 基質) 及びメトホルミ
ン (有機カチオントランスポーター [OCT] 1 及び multidrug and toxin extrusion [MATE] 1 基質)
との薬物相互作用を評価した.
本資料は,第 1 相試験である T1211 試験のコホート A からコホート S,T1215 試験,並びに
第 2/3 相試験である T1221 試験 Phase 2b Part 及び Phase 2a Part の結果に基づいて作成するもの
である.
2.5.1.4
臨床試験実施の基準の遵守
本剤の全ての臨床試験は,医薬品の臨床試験実施基準 (GCP) ガイドライン,ヘルシンキ宣言
に記載された全ての倫理的原則,並びに研究が実施される国の法令に従って実施している.
- 12 -