【資料No.1】2.5_臨床に関する概括資料 (124 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
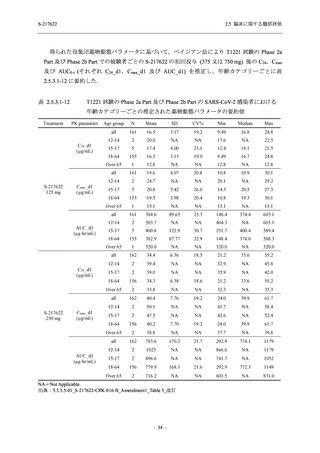
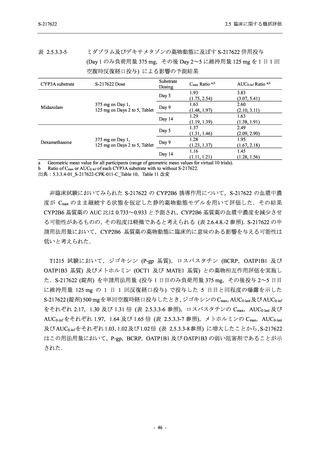
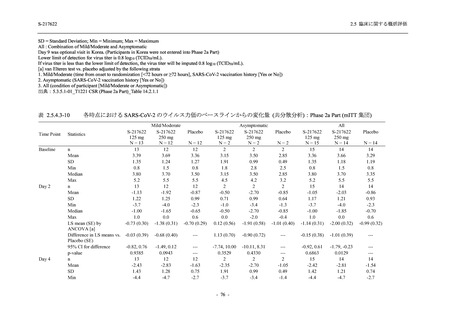
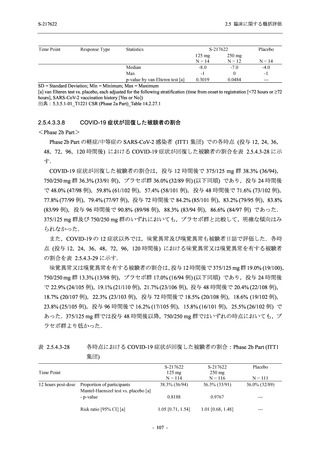
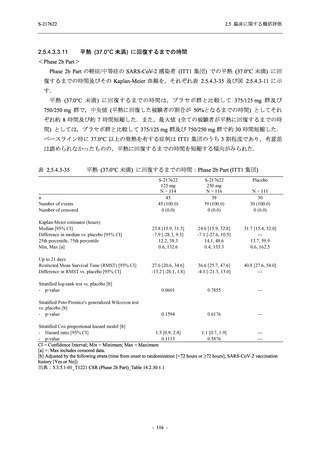
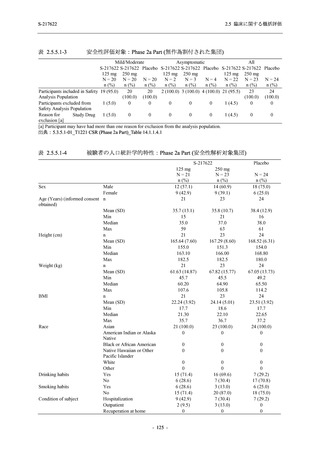
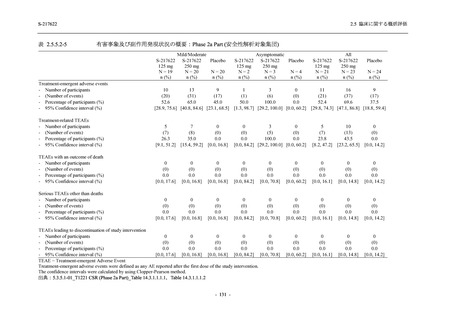
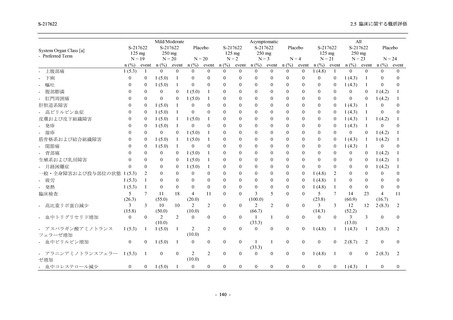
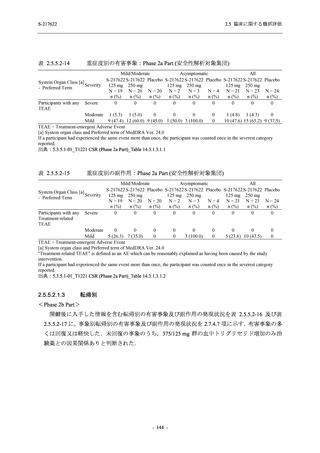
Pathogen Test Method
Time from onset to
randomization (Category 1)
Time from onset to
randomization (Category 2)
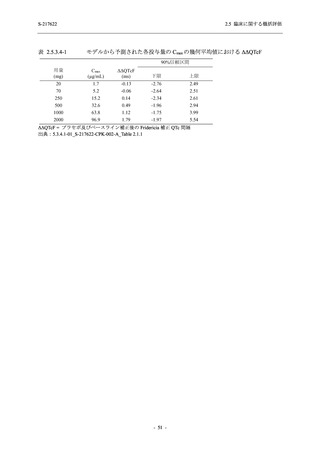
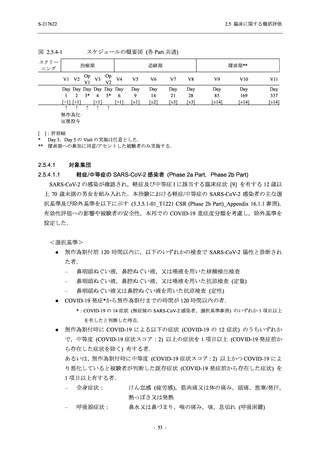
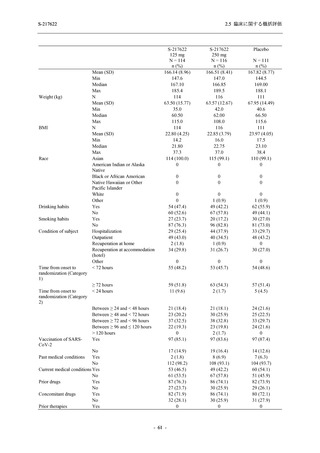
2.5 臨床に関する概括評価
Recuperation at
accommodation (hotel)
Other
Nucleic acid detection test
Antigen test (quantitative
analysis)
Antigen test (qualitative
analysis)
Other
< 72 hours
≥ 72 hours
< 24 hours
Between ≥ 24 and < 48 hours
Between ≥ 48 and < 72 hours
Between ≥ 72 and < 96 hours
Between ≥ 96 and ≤ 120 hours
> 120 hours
Vaccination of SARS-CoV-2
Yes
No
Past medical conditions
Yes
No
Current medical conditions
Yes
No
Prior drugs
Yes
No
Concomitant drugs
Yes
No
Prior therapies
Yes
No
Concomitant therapies
Yes
No
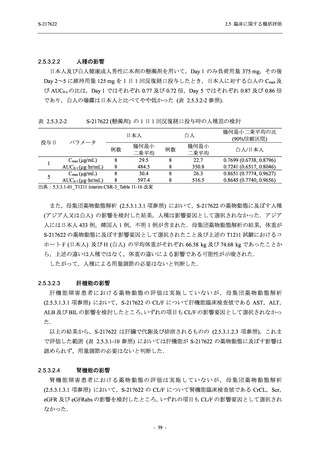
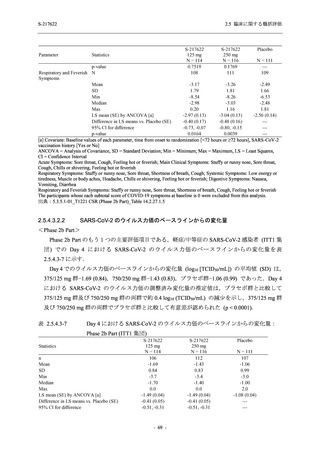
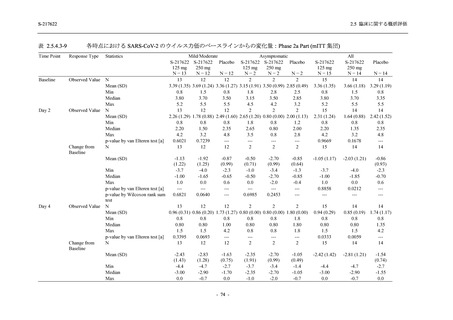
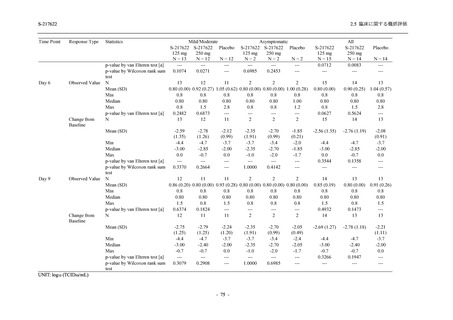
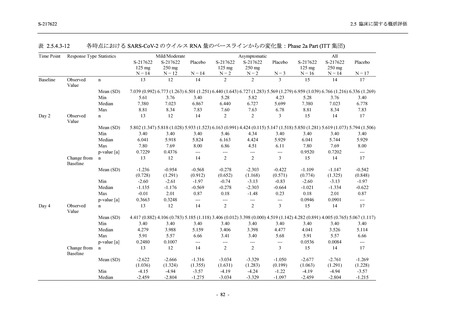
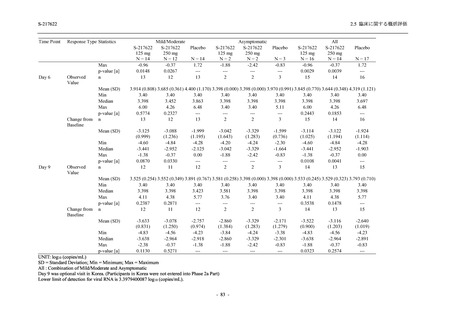
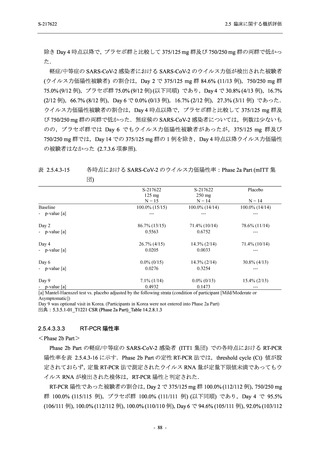
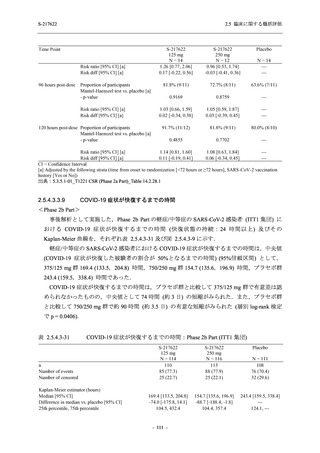
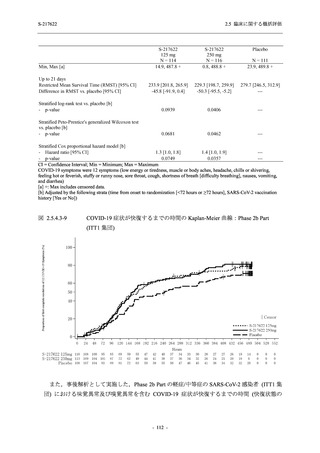
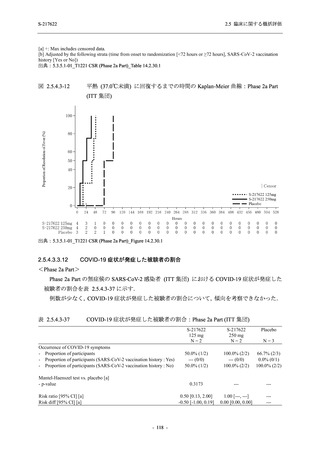
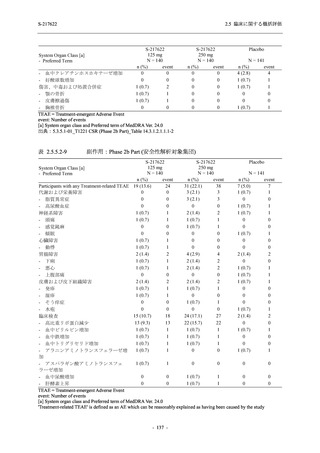
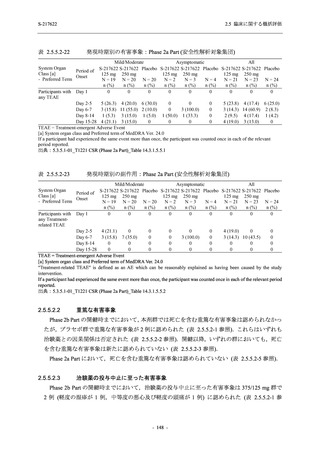
出典:5.3.5.1-01_T1221 CSR (Phase 2b Part)_Table 14.1.2.1.2.1.1
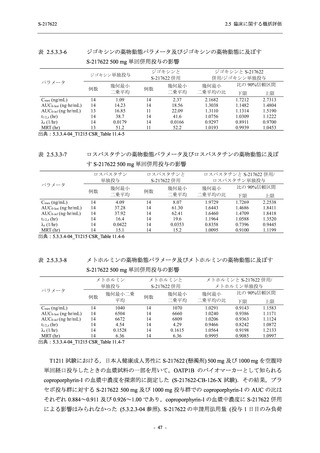
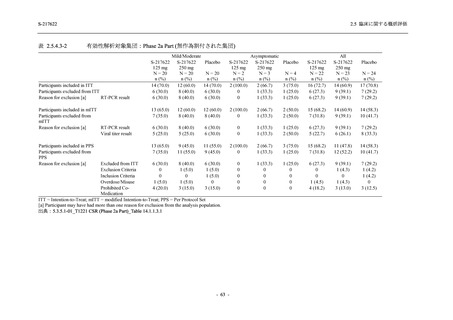
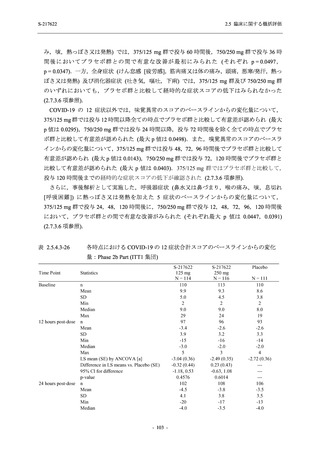
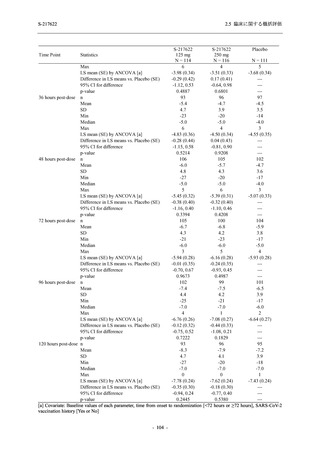
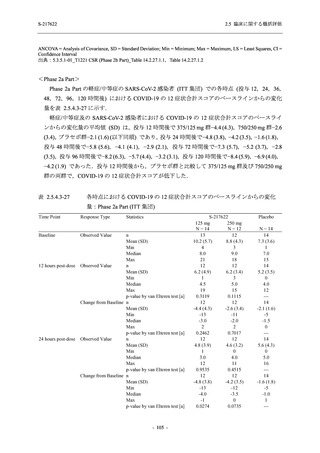
S-217622
125 mg
N = 140
n (%)
40 (28.6)
S-217622
250 mg
N = 140
n (%)
36 (25.7)
Placebo
N = 141
n (%)
40 (28.4)
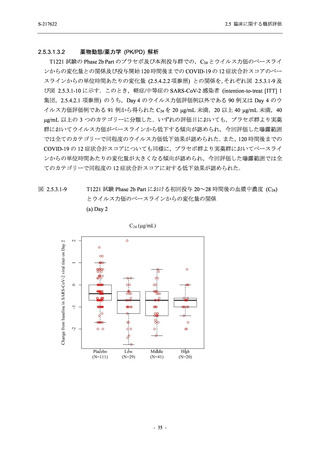
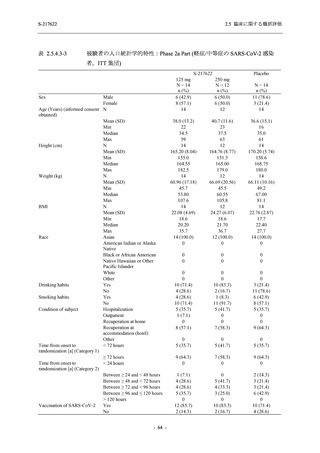
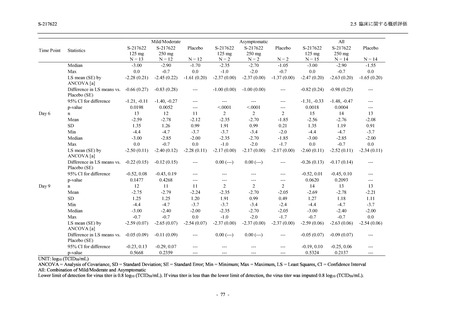
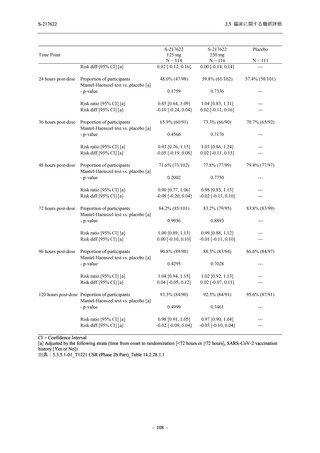
0
96 (68.6)
7 (5.0)
0
103 (73.6)
6 (4.3)
0
107 (75.9)
4 (2.8)
36 (25.7)
31 (22.1)
27 (19.1)
1 (0.7)
64 (45.7)
0
65 (46.4)
3 (2.1)
67 (47.5)
76 (54.3)
15 (10.7)
75 (53.6)
8 (5.7)
74 (52.5)
8 (5.7)
23 (16.4)
26 (18.6)
41 (29.3)
35 (25.0)
0
119 (85.0)
21 (15.0)
3 (2.1)
137 (97.9)
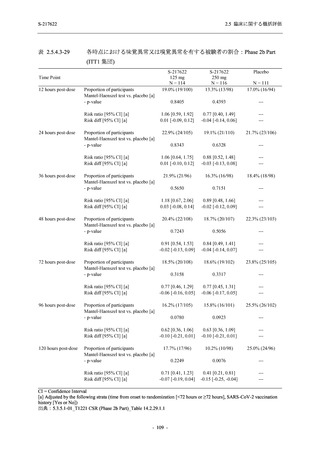
65 (46.4)
75 (53.6)
103 (73.6)
37 (26.4)
99 (70.7)
41 (29.3)
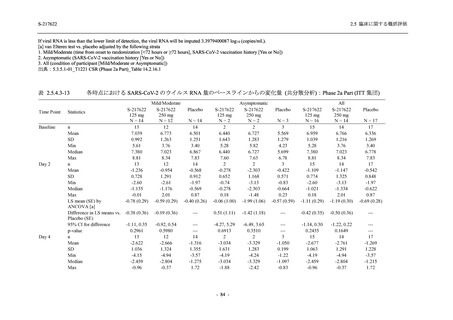
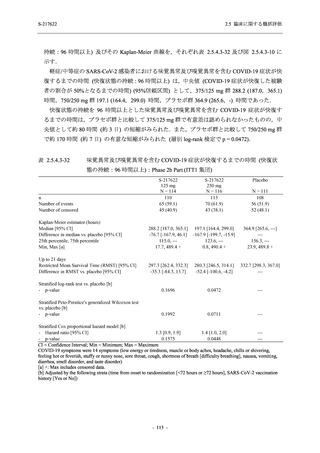
0
140 (100.0)
0
140 (100.0)
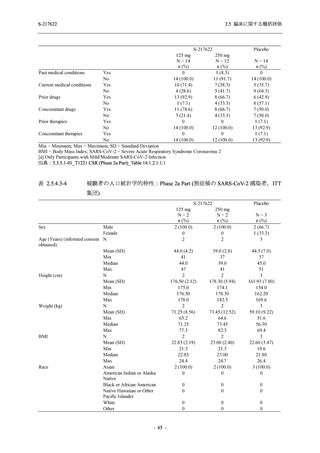
22 (15.7)
35 (25.0)
45 (32.1)
28 (20.0)
2 (1.4)
118 (84.3)
22 (15.7)
9 (6.4)
131 (93.6)
60 (42.9)
80 (57.1)
96 (68.6)
44 (31.4)
99 (70.7)
41 (29.3)
0
140 (100.0)
0
140 (100.0)
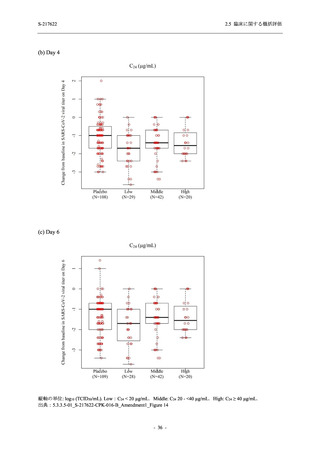
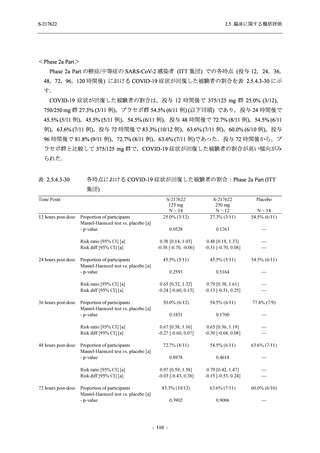
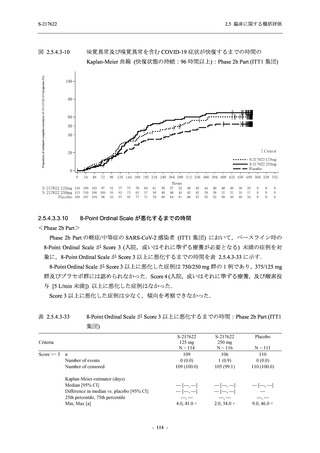
26 (18.4)
33 (23.4)
40 (28.4)
34 (24.1)
0
121 (85.8)
20 (14.2)
8 (5.7)
133 (94.3)
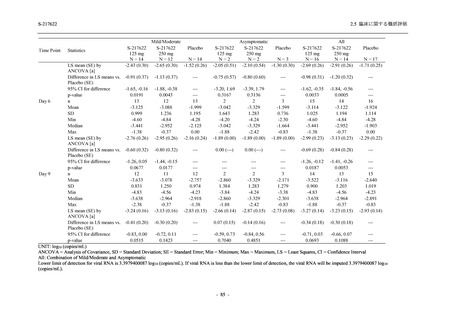
73 (51.8)
68 (48.2)
96 (68.1)
45 (31.9)
104 (73.8)
37 (26.2)
0
141 (100.0)
2 (1.4)
139 (98.6)
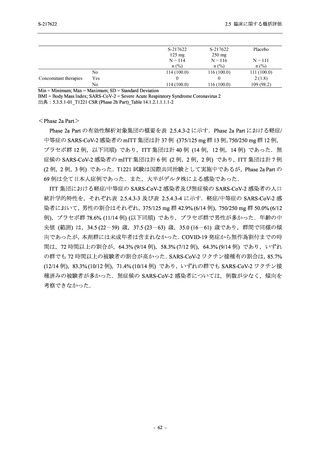
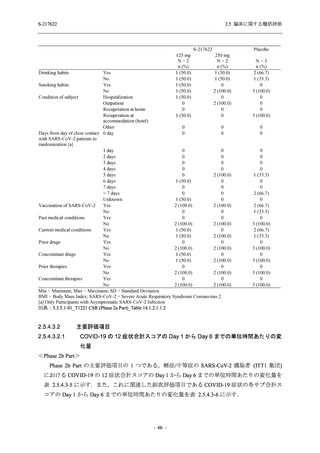
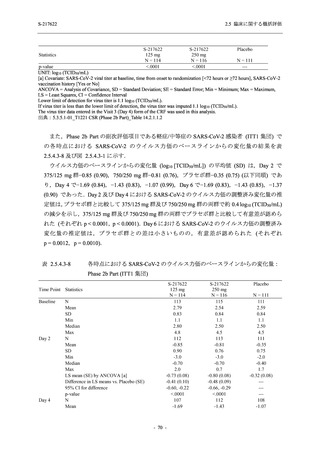
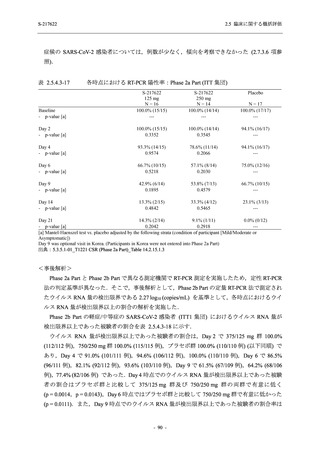
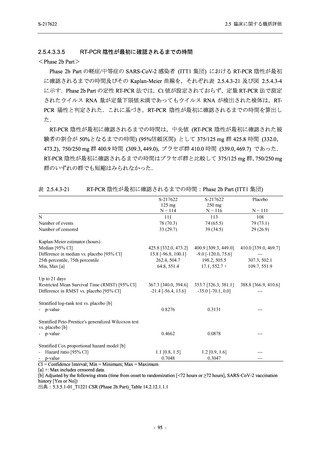
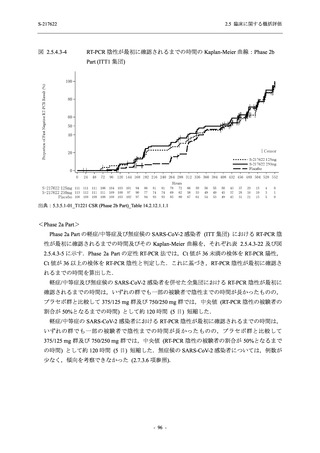
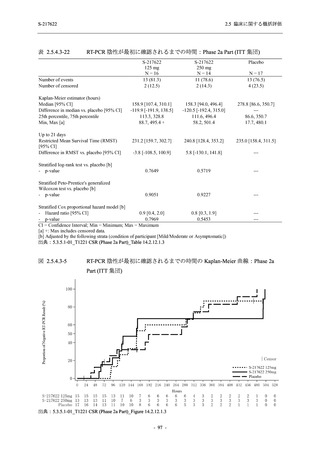
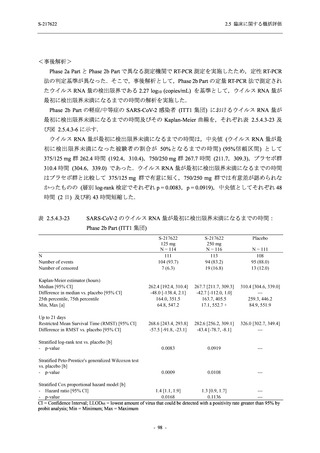
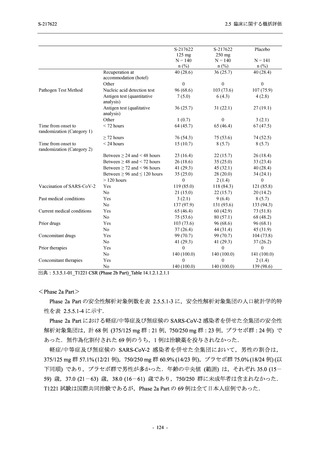
<Phase 2a Part>
Phase 2a Part の安全性解析対象例数を表 2.5.5.1-3 に,安全性解析対象集団の人口統計学的特
性を表 2.5.5.1-4 に示す.
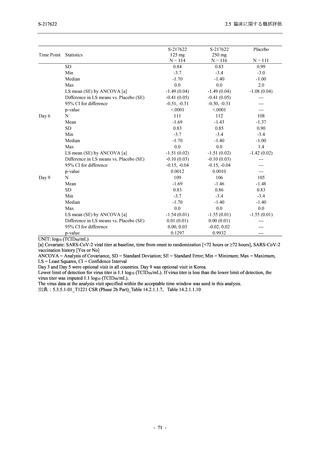
Phase 2a Part における軽症/中等症及び無症候の SARS-CoV-2 感染者を併せた全集団の安全性
解析対象集団は,計 68 例 (375/125 mg 群:21 例,750/250 mg 群:23 例,プラセボ群:24 例) で
あった.無作為化割付された 69 例のうち,1 例は治験薬を投与されなかった.
軽症/中等症及び無症候の SARS-CoV-2 感染者を併せた全集団において,男性の割合は,
375/125 mg 群 57.1% (12/21 例),750/250 mg 群 60.9% (14/23 例),プラセボ群 75.0% (18/24 例) (以
下同順) であり,プラセボ群で男性が多かった.年齢の中央値 (範囲) は,それぞれ 35.0 (15-
59) 歳,37.0 (21-63) 歳,38.0 (16-61) 歳であり,750/250 群に未成年者は含まれなかった.
T1221 試験は国際共同治験であるが,Phase 2a Part の 69 例は全て日本人症例であった.
- 124 -