【資料No.1】2.5_臨床に関する概括資料 (130 ページ)
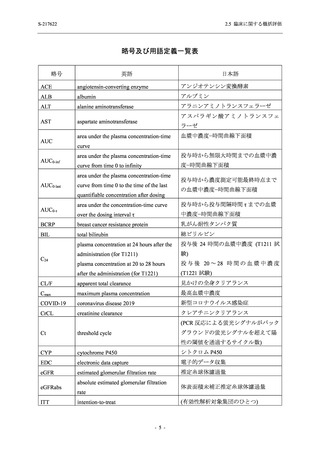
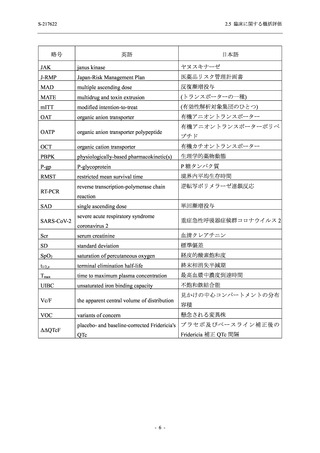
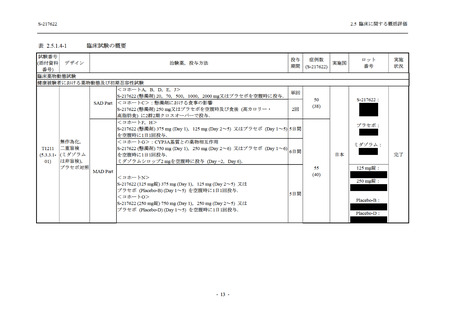
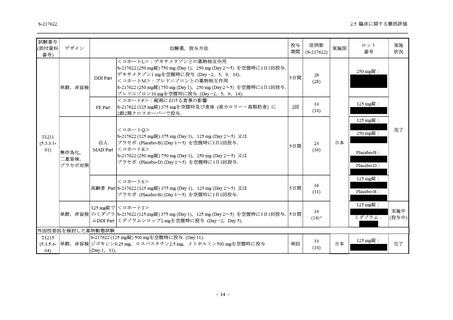
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
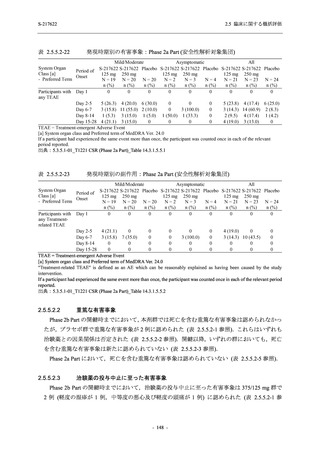
2.5 臨床に関する概括評価
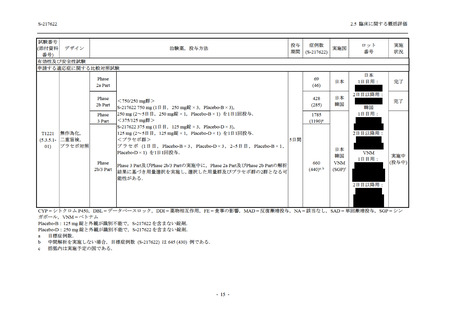
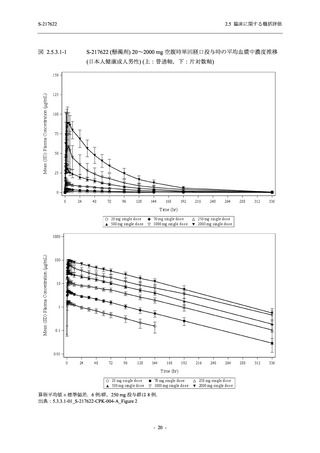
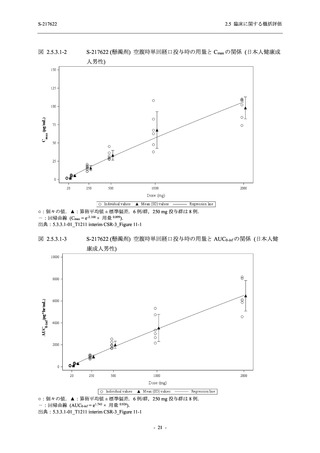
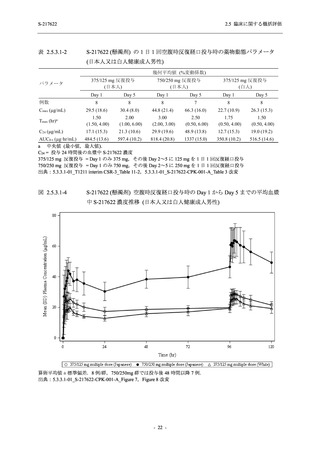
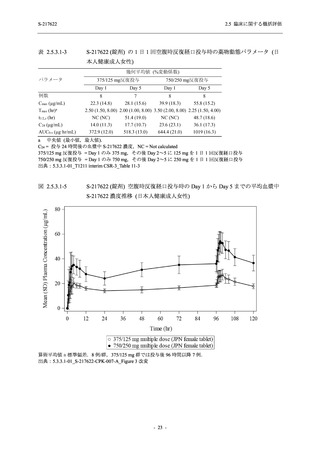
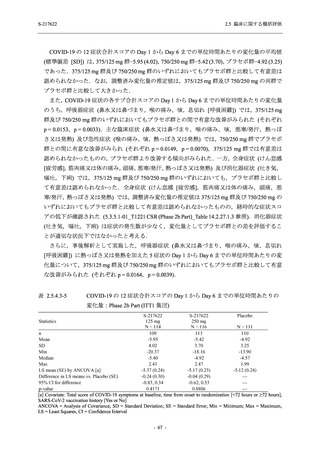
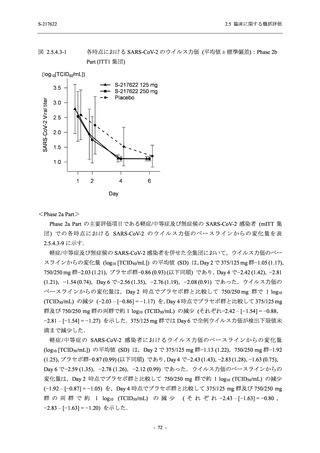
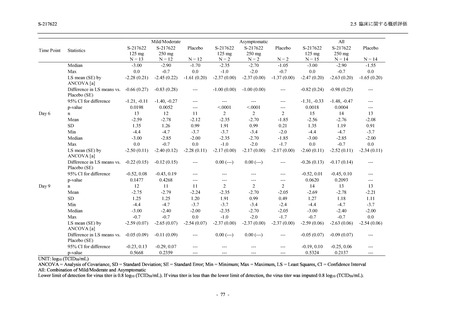
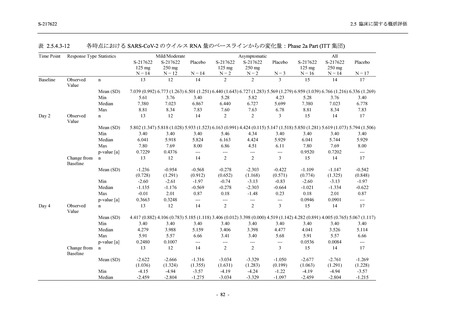
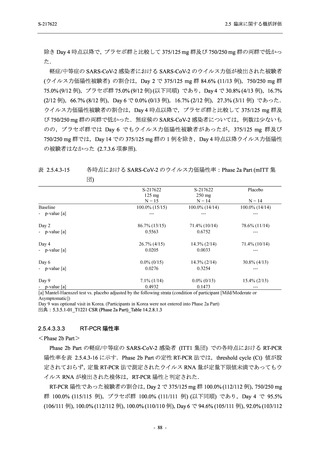
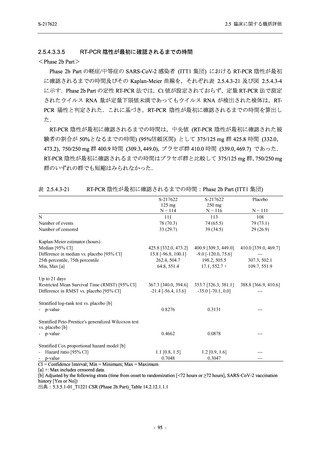
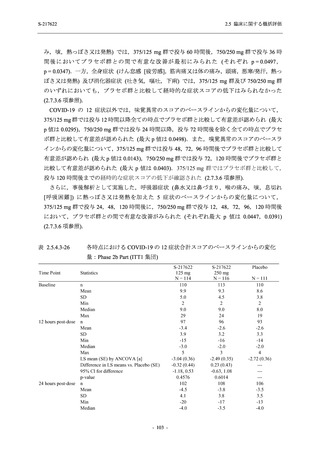
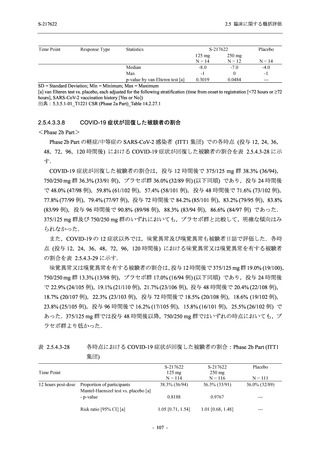
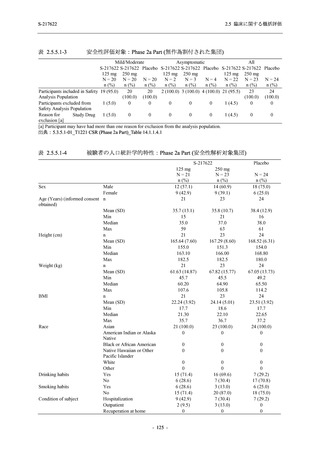
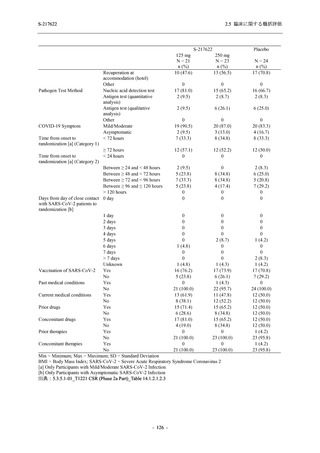
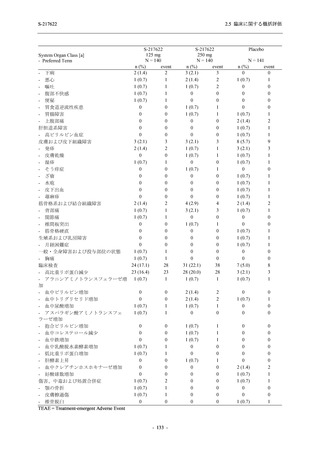
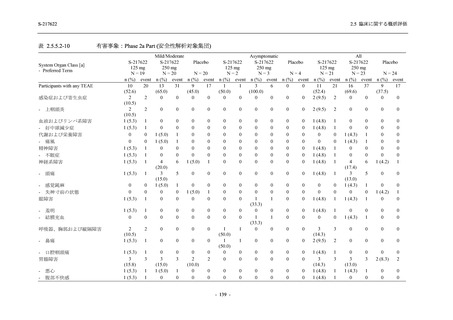
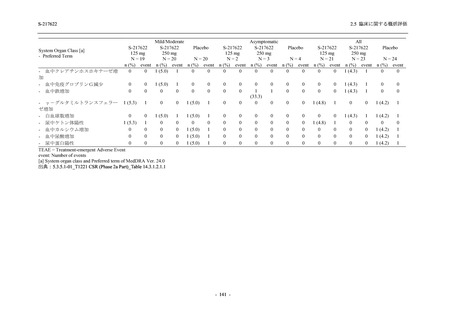
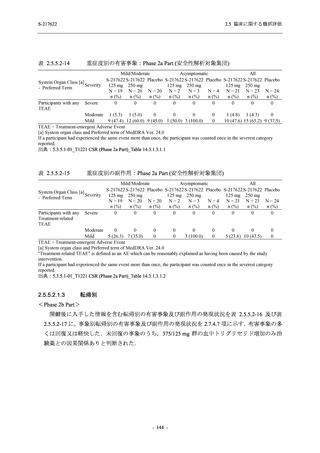
S-217622
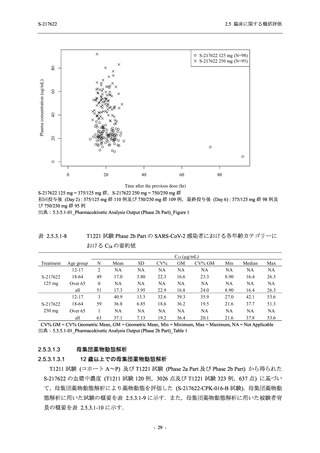
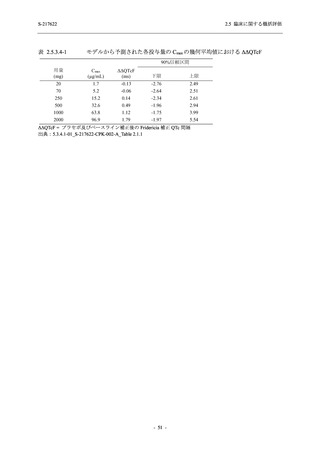
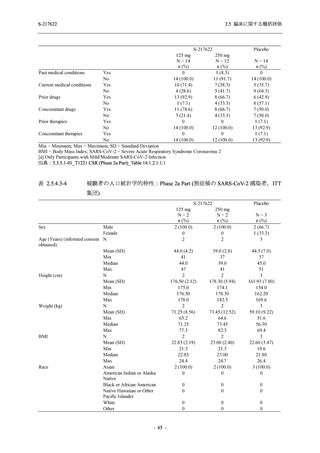
125 mg
N = 140
2
(3)
1.4
[0.2, 5.1]
S-217622
250 mg
N = 140
0
(0)
0.0
[0.0, 2.6]
Placebo
N = 141
- Number of participants
0
- (Number of events)
(0)
- Percentage of participants (%)
0.0
- 95% Confidence interval (%)
[0.0, 2.6]
TEAE = Treatment-emergent Adverse Event
'Treatment-related TEAE' is defined as an AE which can be reasonably explained as having been caused by the study
intervention.
The confidence intervals were calculated by using Clopper-Pearson method.
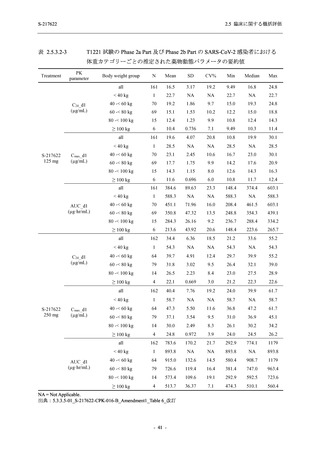
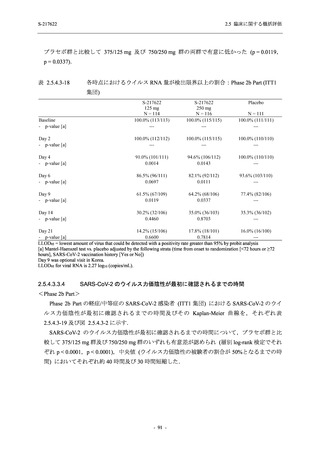
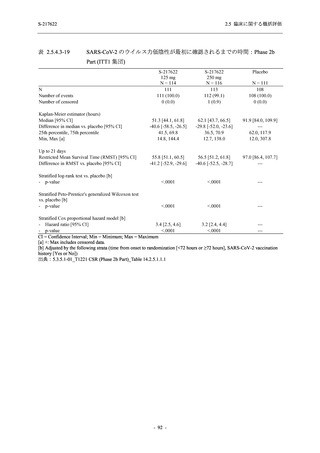
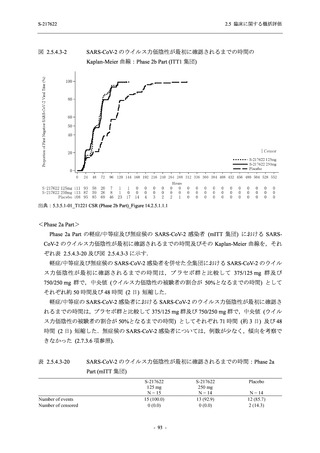
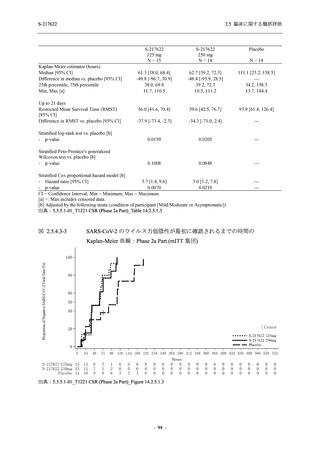
出典:5.3.5.1-01_T1221 CSR (Phase 2b Part)_Table 14.3.1.1.1.2.1-2
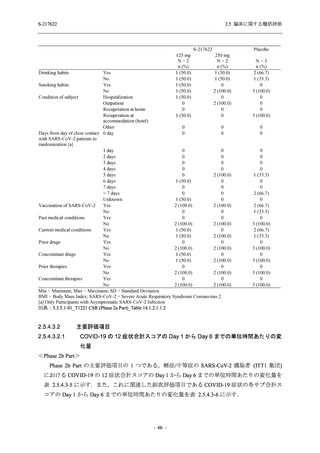
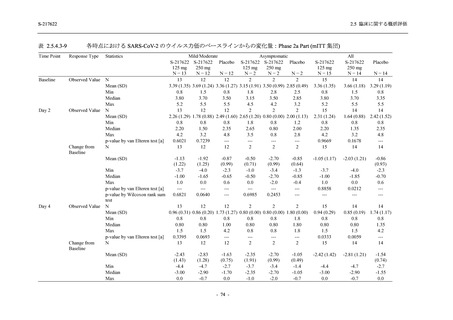
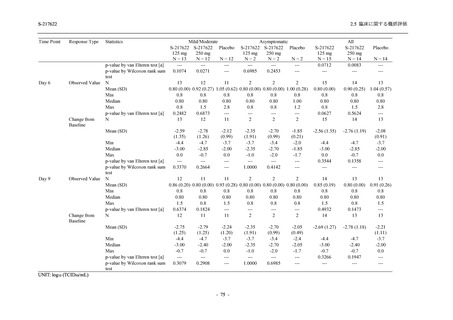
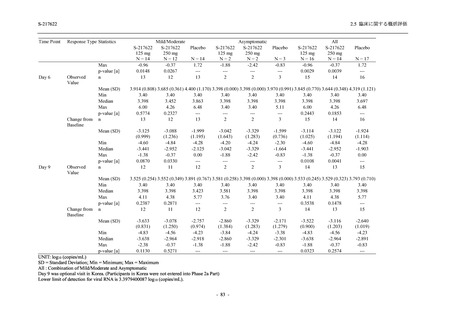
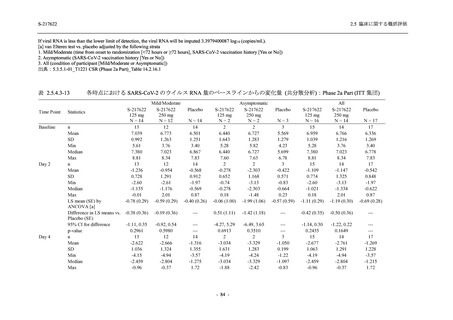
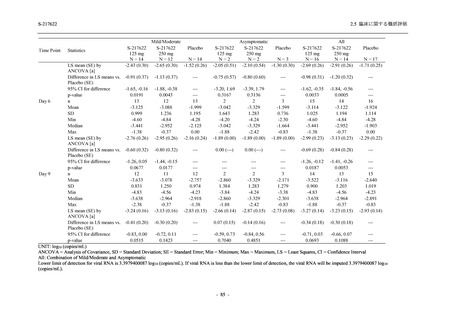
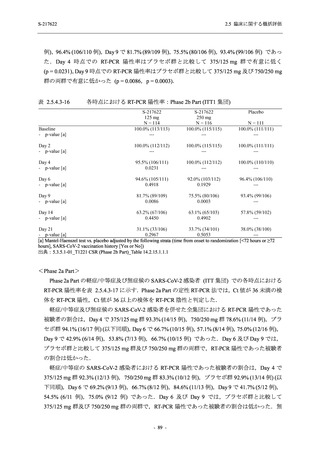
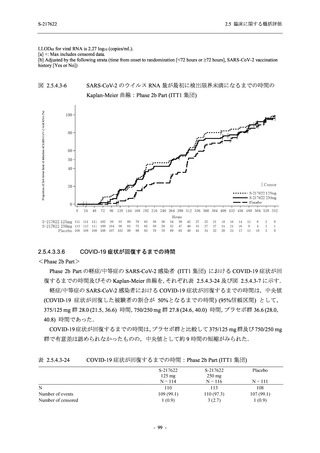
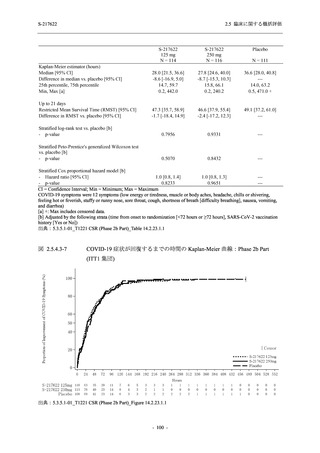
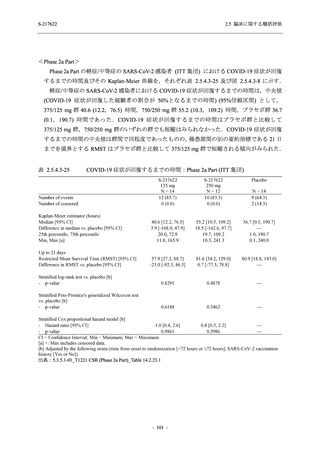
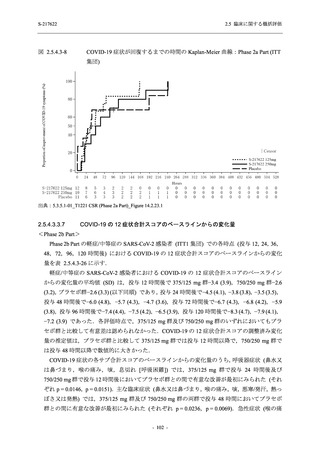
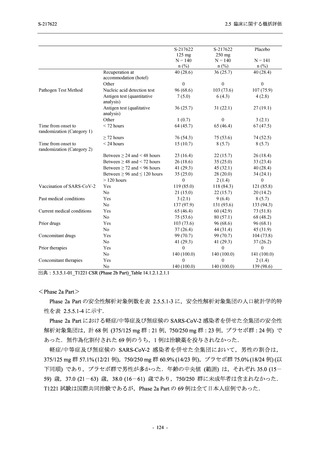
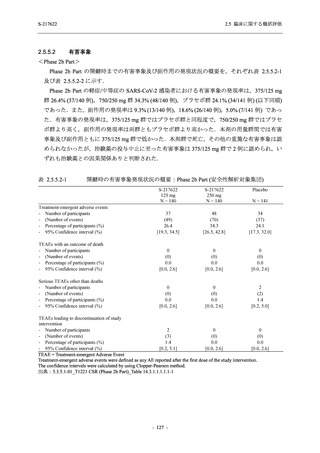
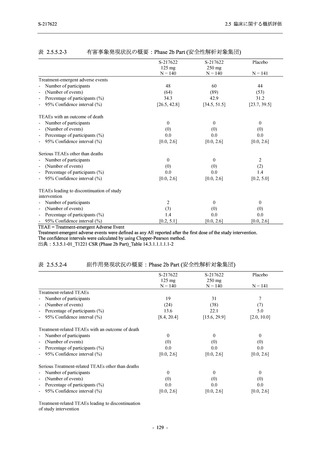
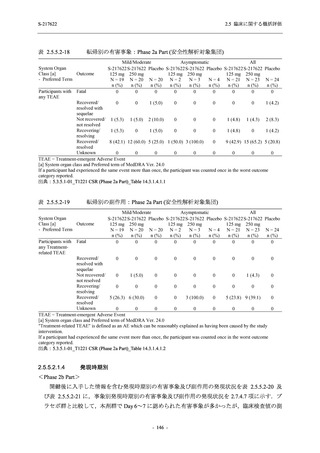
<Phase 2a Part>
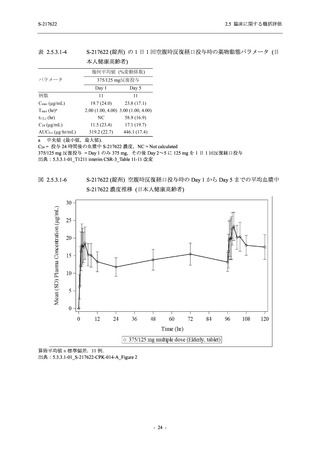
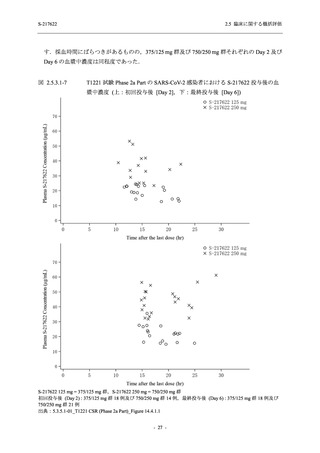
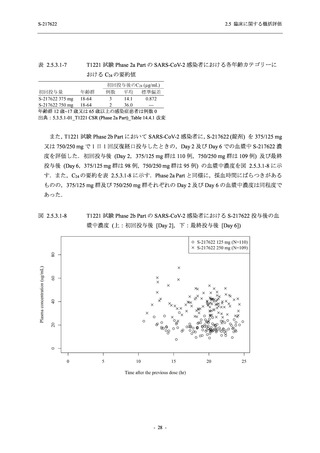
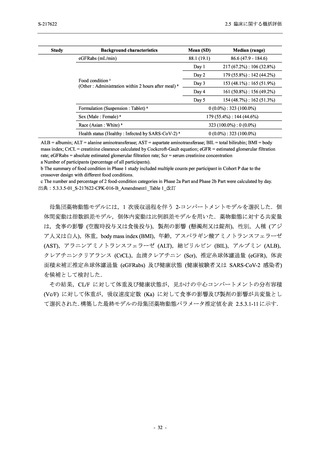
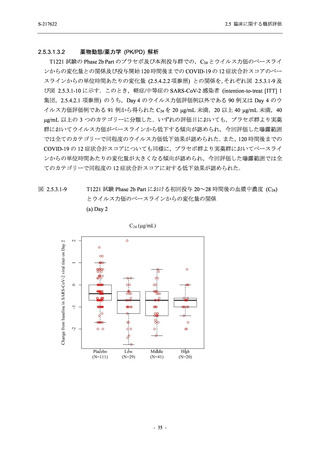
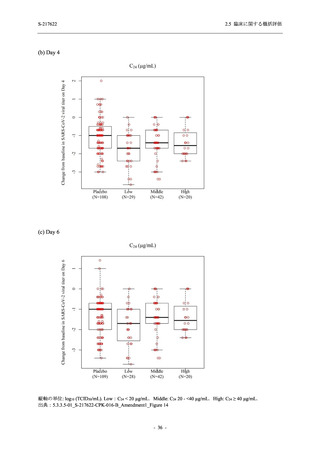
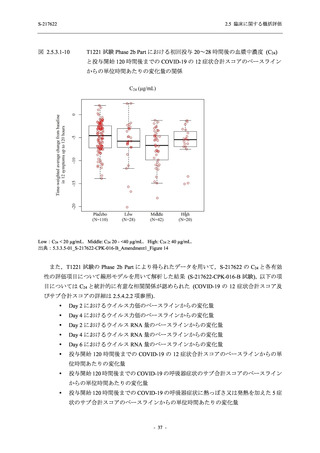
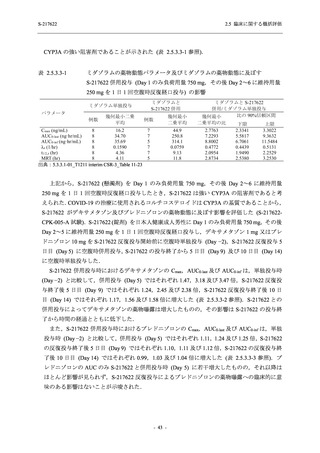
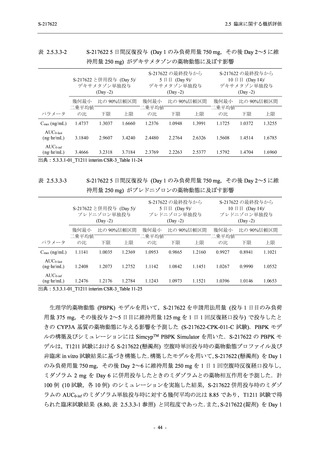
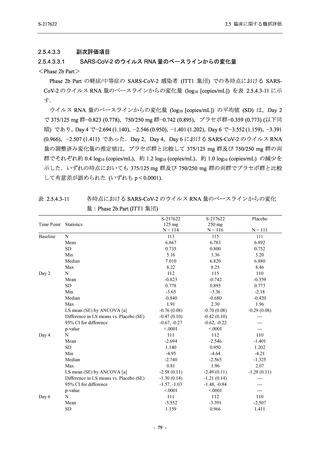
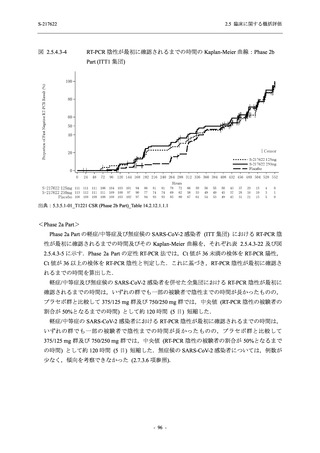
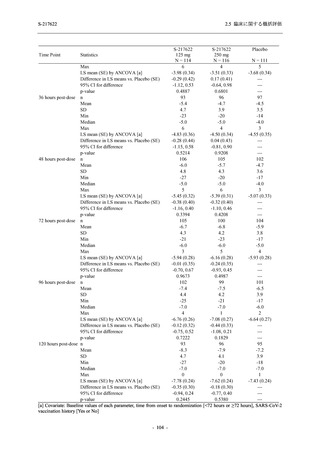
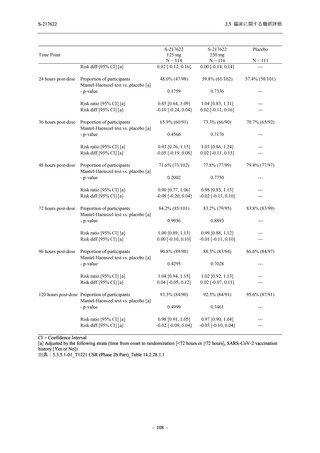
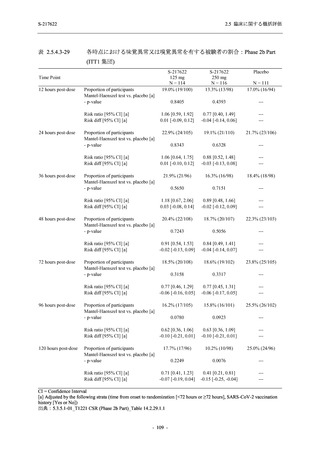
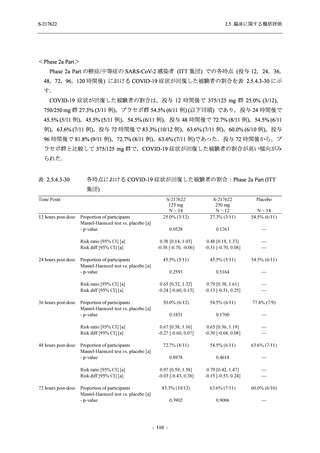
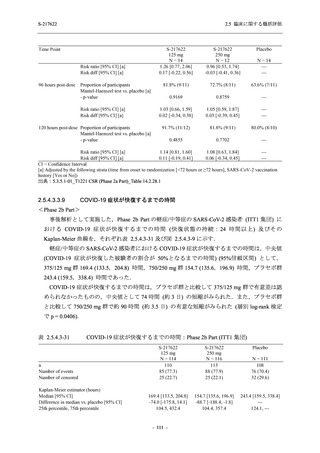
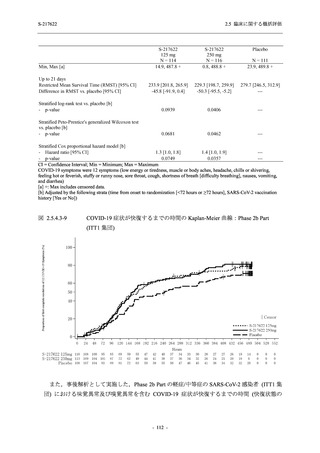
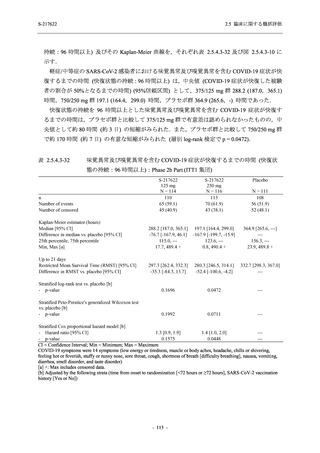
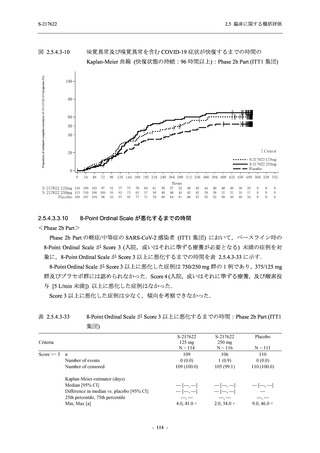
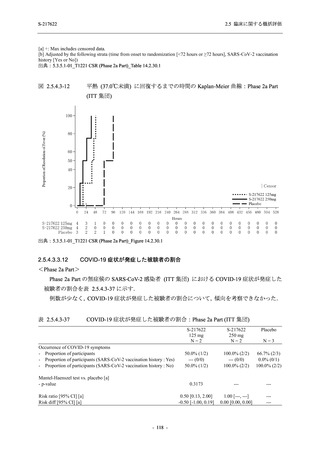
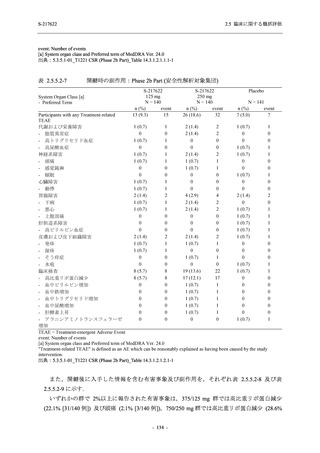
Phase 2a Part の有害事象及び副作用の発現状況の概要を表 2.5.5.2-5 に示す.
軽症/中等症及び無症候の SARS-CoV-2 感染者を併せた全集団の有害事象の発現率は,
375/125 mg 群 52.4% (11/21 例),750/250 mg 群 69.6% (16/23 例),プラセボ群 37.5% (9/24 例) で
あった.また,副作用の発現率は,375/125 mg 群 23.8% (5/21 例),750/250 mg 群 43.5% (10/23
例),プラセボ群 0% (0/24 例) であった.本剤群の有害事象及び副作用の発現率はプラセボ群よ
り高く,用量群間では 375/125 mg 群で低かった.また,死亡,その他の重篤な有害事象及び治
験薬の投与中止に至った有害事象はみられなかった.
- 130 -