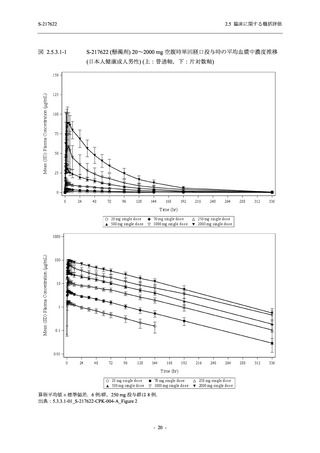
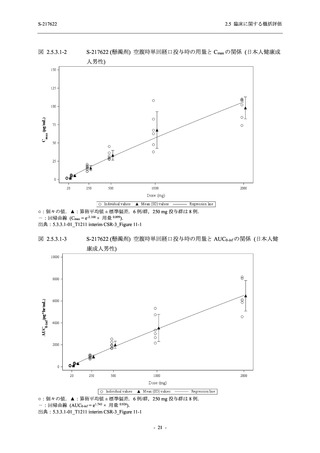
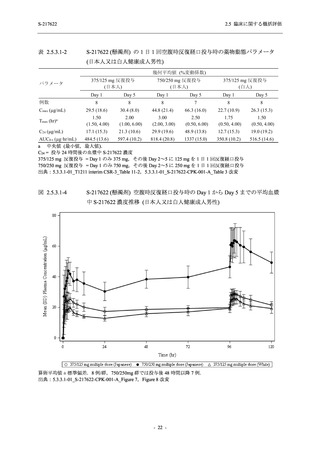
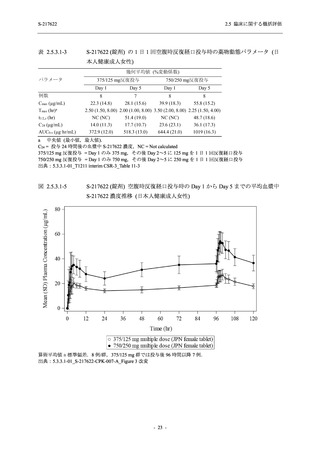
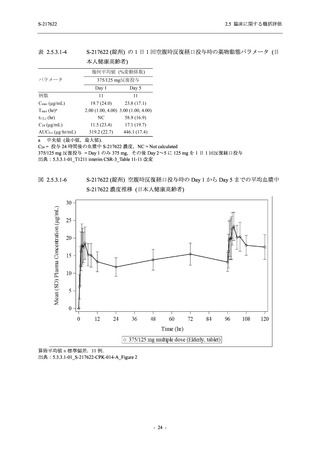
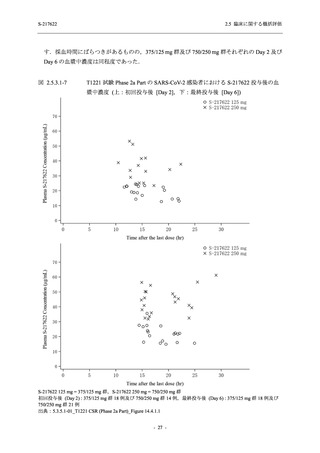
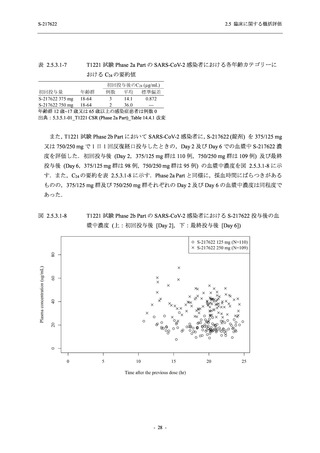
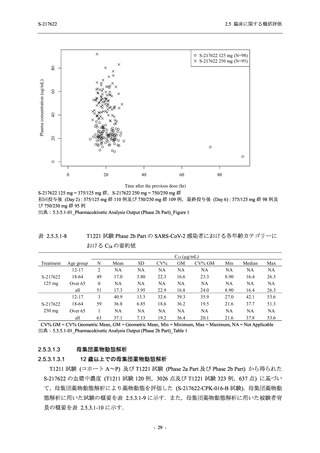
【資料No.1】2.5_臨床に関する概括資料 (122 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.5.5
2.5 臨床に関する概括評価
安全性の概括評価
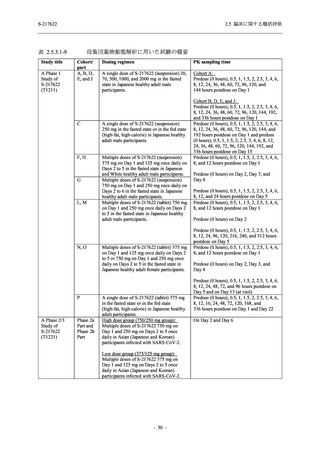
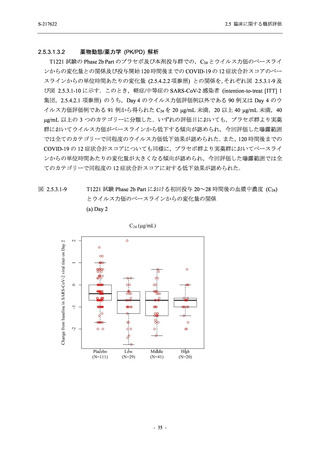
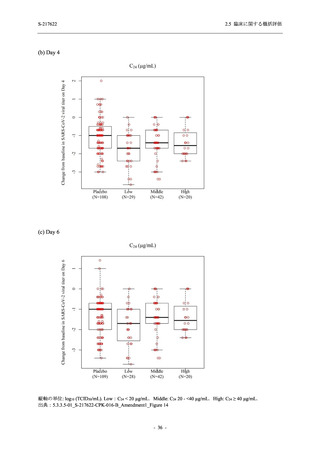
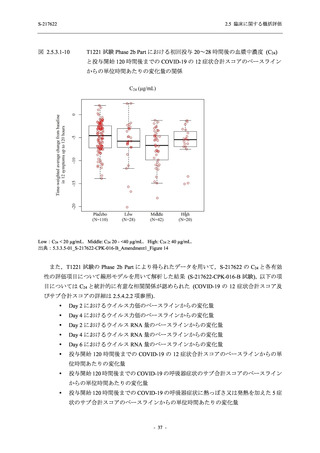
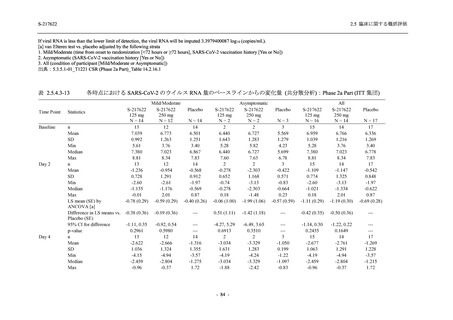
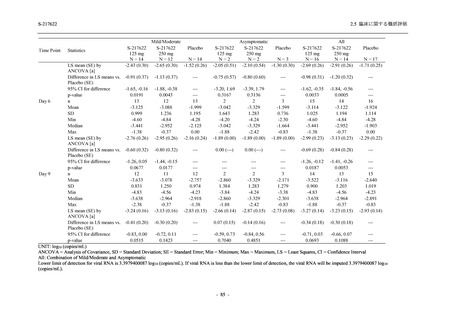
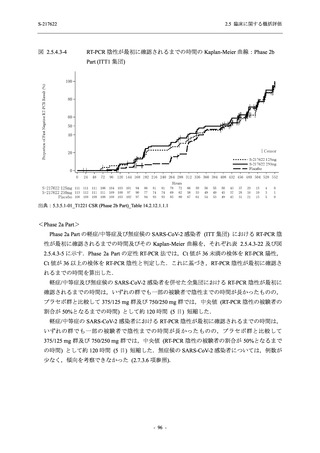
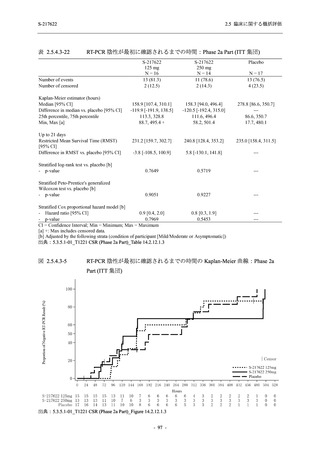
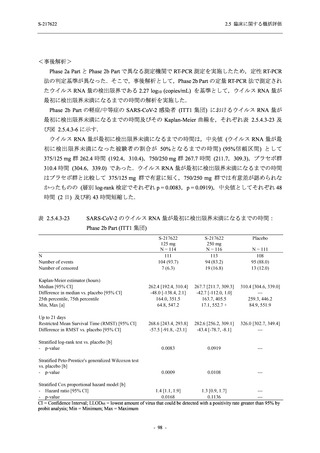
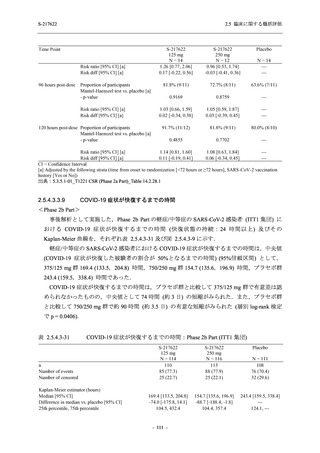
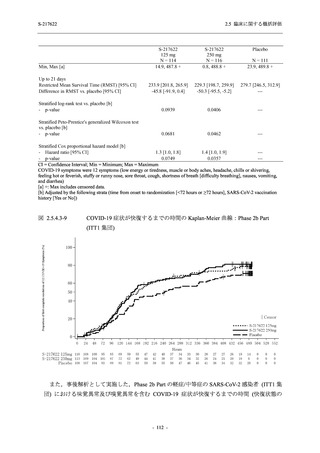
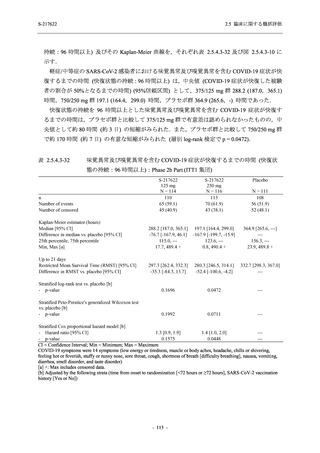
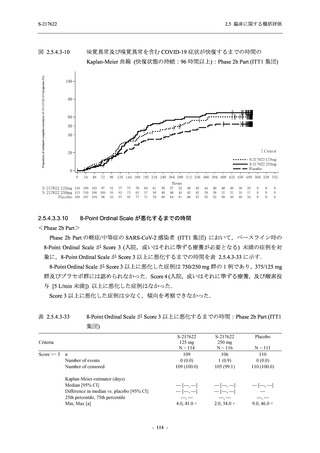
SARS-CoV-2 感染者に対する本剤の安全性を,T1221 試験 Phase 2b Part 及び Phase 2a Part の
データを用いて評価した.Phase 2b Part では,全ての被験者において評価期間 (Day 6 まで) が
完了した時点で開鍵し,その後は参考情報として Day 14 及び治験期間 (Day 28 まで) が完了し
た時点で安全性を評価した.本項では,開鍵時として評価期間 (Day 6) までの結果を示し,特
に記載がない場合は治験期間 (Day 28) 完了時の結果を示す.また,Day 14 までの結果は 2.7.4
項に示す.
治験薬投与開始後に新たに発現した事象,重症度や頻度が悪化した事象,バイタルサイン,
心電図,及び臨床検査の臨床的意義がある変動などを有害事象とし,これらの発現頻度及び事
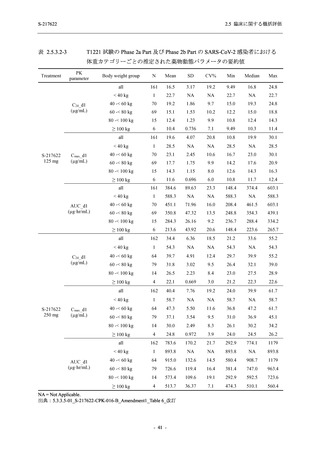
象に基づき,本剤の安全性を評価した.本項では,報告された有害事象名を ICH 国際医薬用語
集 (MedDRA) version 24.0 の器官別大分類 (System Organ Class) 及び基本語 (Preferred Term) に
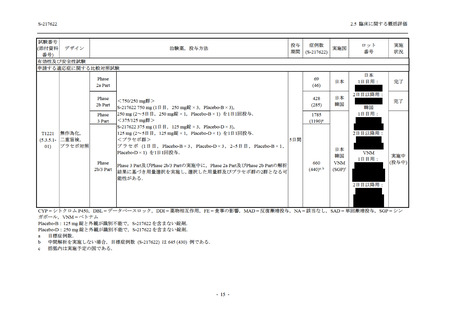
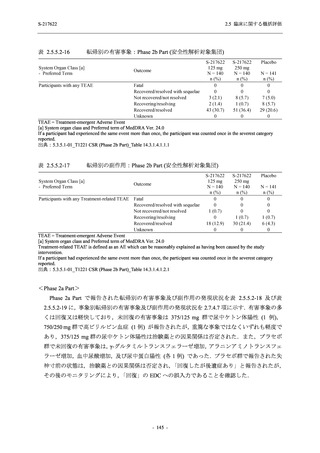
読み替えて集計した.有害事象と治験薬との因果関係,重症度は表 2.5.5-1 の定義に従い,治験
責任 (分担) 医師が判定した.
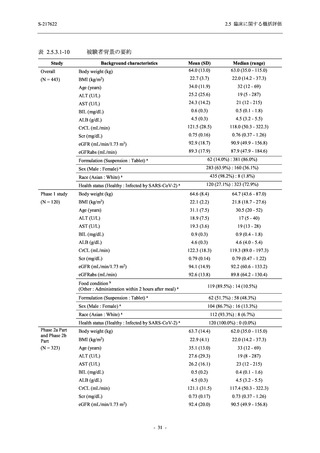
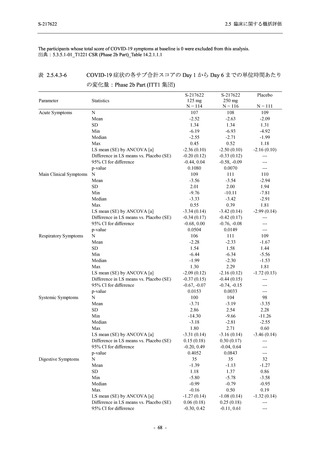
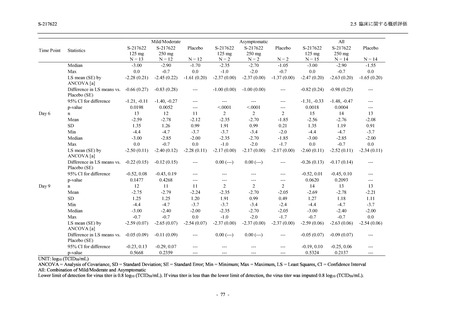
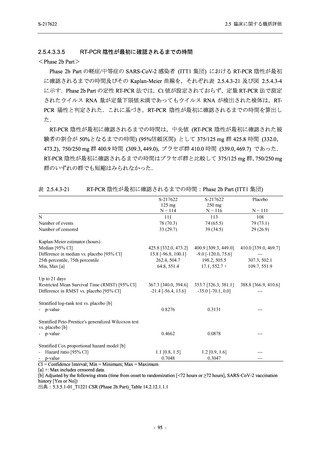
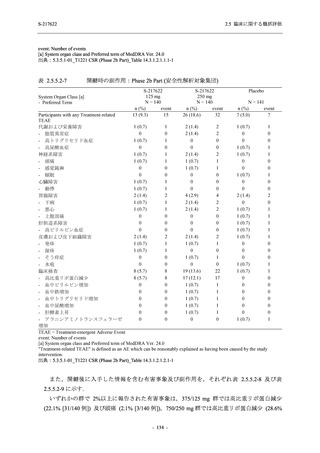
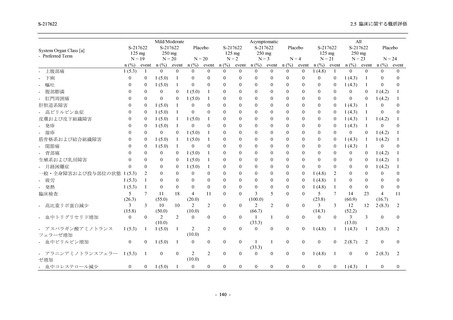
表 2.5.5-1
因果関係
関連あり
関連なし
重症度
軽度
中等度
高度
2.5.5.1
治験薬との因果関係及び重症度の判定基準
有害事象の原因が治験薬であることが合理的に説明できるもの
有害事象の原因が治験薬であることが合理的に説明できないもの
容易に我慢でき,不快さがわずかであり日常生活に支障がない程度の有害事象
不快感のため日常生活に支障を来す程度の有害事象
通常の日常生活が営めない程度の有害事象
患者集団及び曝露状況の概要
安全性解析対象集団は,治験薬を少なくとも 1 回投与された被験者からなる集団と定義し,
実際に初回投与された治験薬に基づき解析した.
<Phase 2b Part>
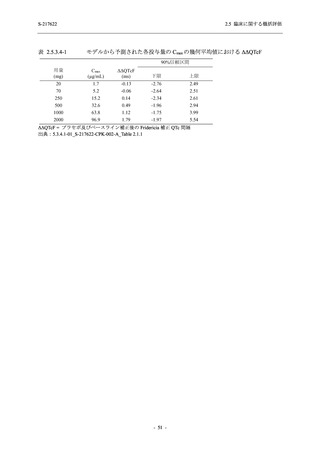
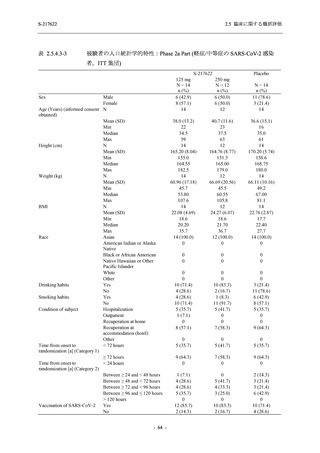
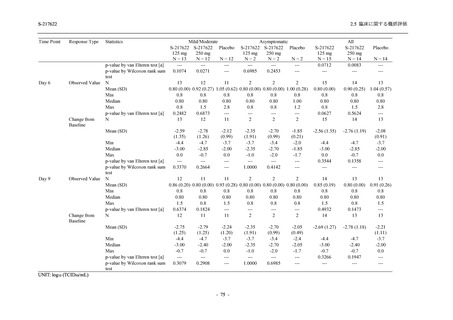
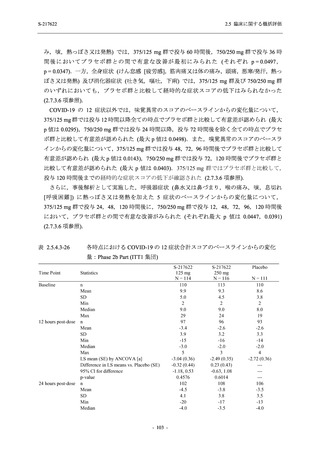
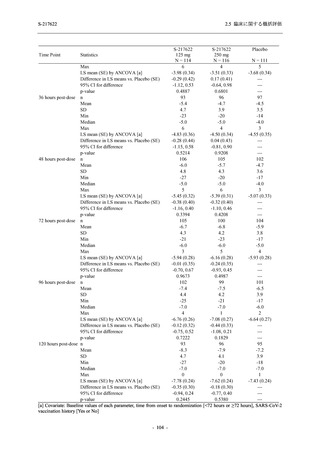
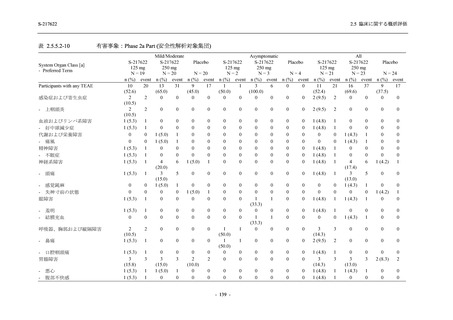
Phase 2b Part の安全性解析対象例数を表 2.5.5.1-1 に,安全性解析対象集団の人口統計学的特
性を表 2.5.5.1-2 に示す.
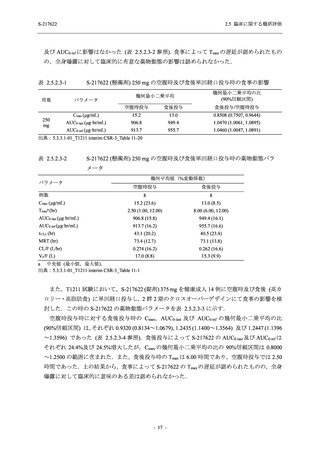
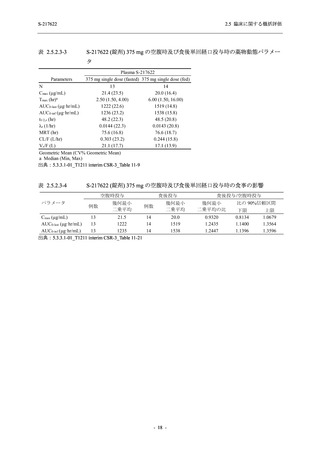
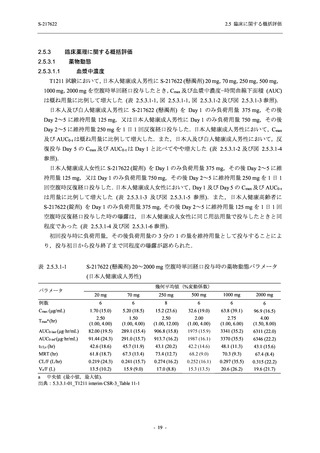
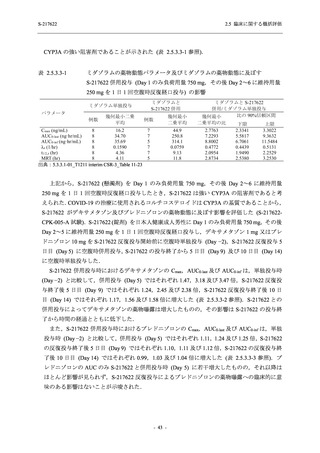
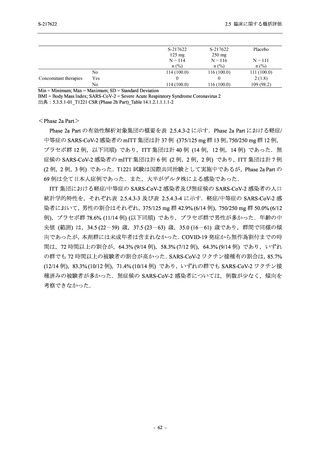
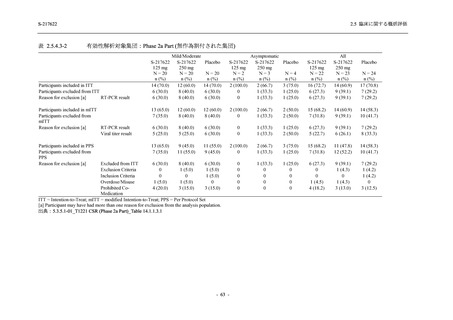
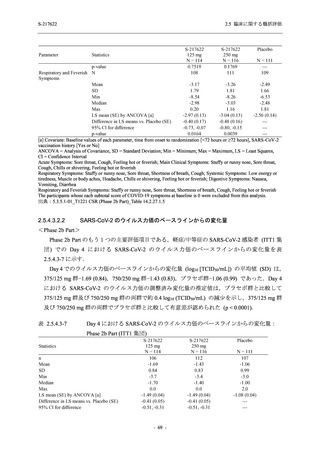
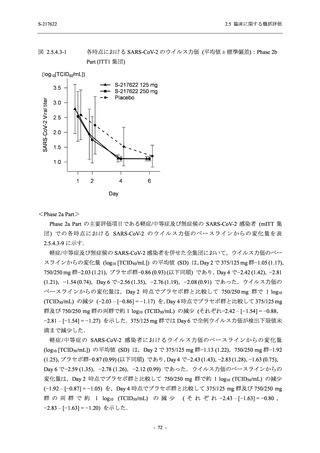
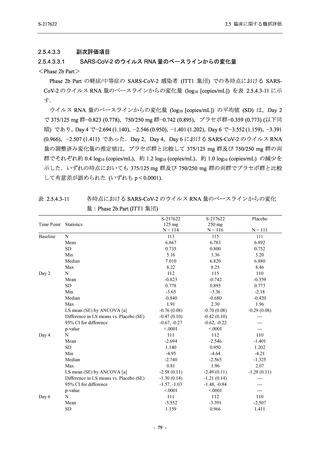
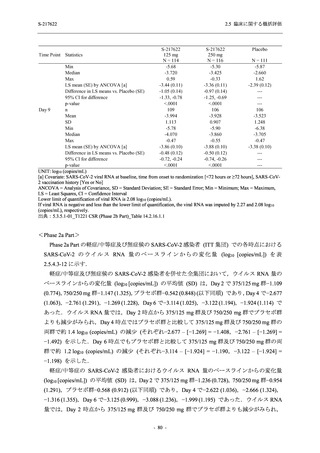
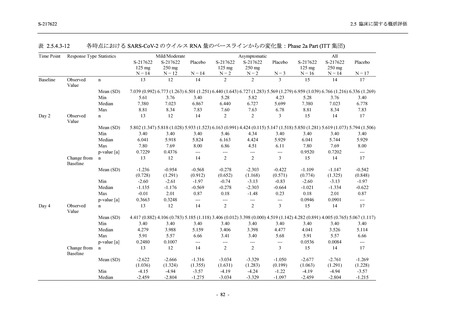
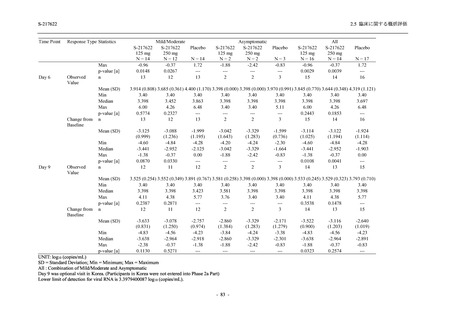
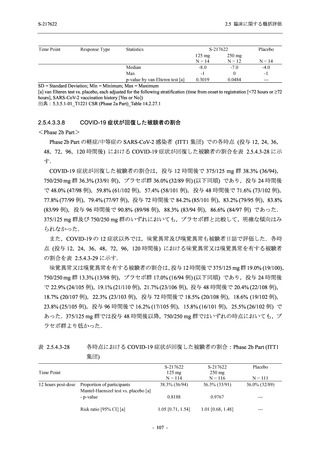
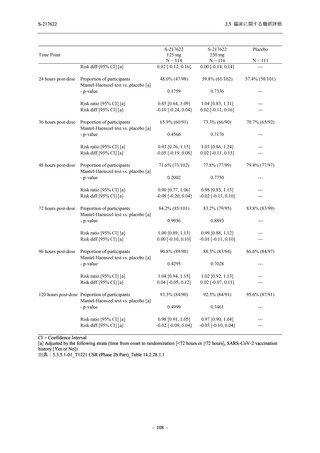
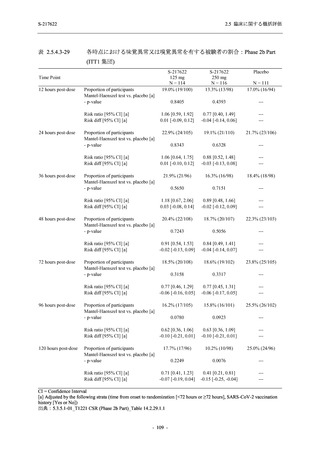
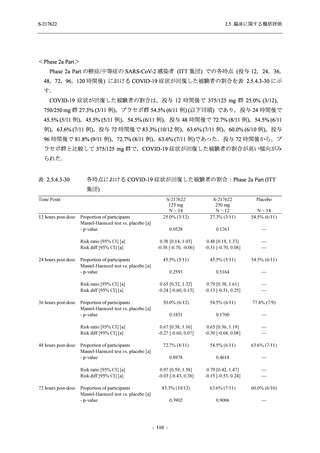
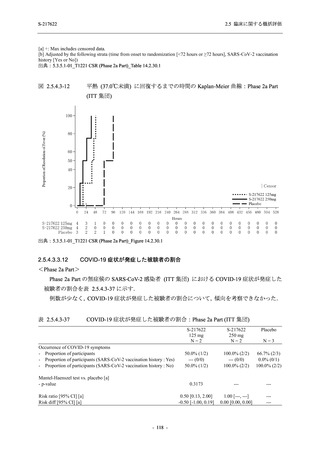
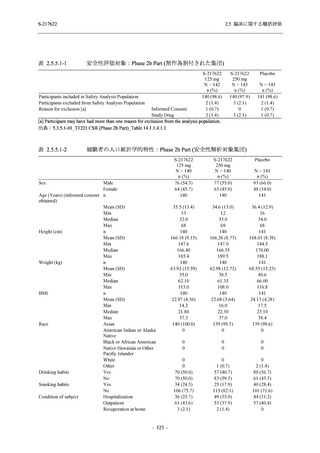
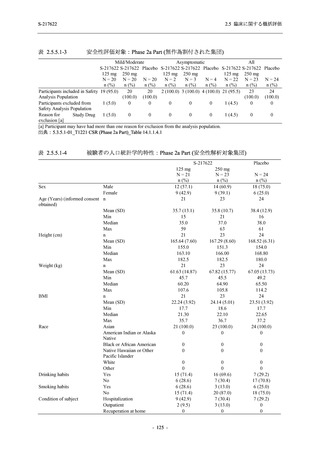
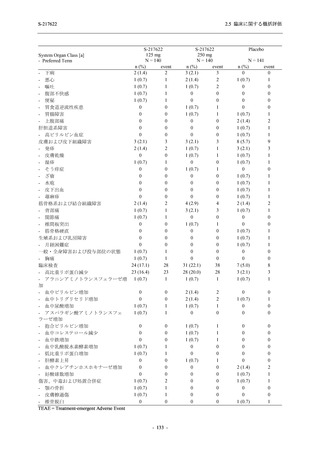
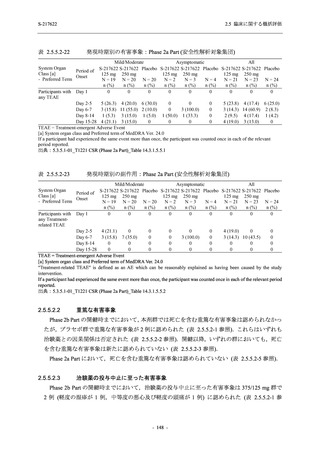
Phase 2b Part における安全性解析対象集団は,計 421 例 (375/125 mg 群:140 例,750/250 mg
群:140 例,プラセボ群:141 例) であった (表 2.5.5.2-1 参照).無作為化割付された 428 例 (日
本人 419 例) のうち,7 例は治験薬を投与されなかった.いずれの群においても,95%以上の被
験者が 5 日間の投与を完了した.
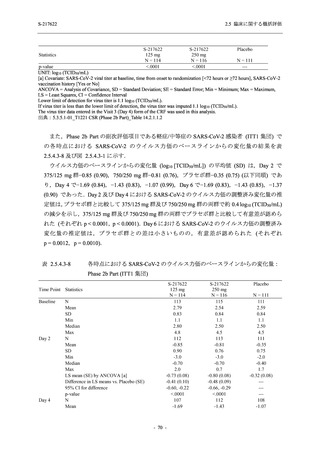
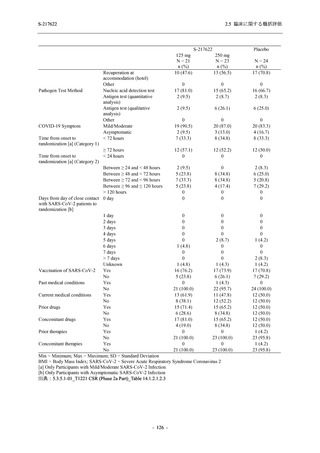
男性の割合は,375/125 mg 群 54.3% (76/140 例),750/250 mg 群 55.0% (77/140 例),プラセボ群
66.0% (93/141 例) (以下同順) であり,プラセボ群で男性が多かった.年齢の中央値 (範囲) は,
それぞれ 32.0 (13-68) 歳,33.0 (12-69) 歳,34.0 (16-68) 歳であった.Phase 2b Part は日本及
び韓国で実施され,750/250 mg 群の 1 例及びプラセボ群の 2 例を除き,いずれの被験者もアジ
ア人であった.
- 122 -