よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律等に関するQ&Aについて[697KB] (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
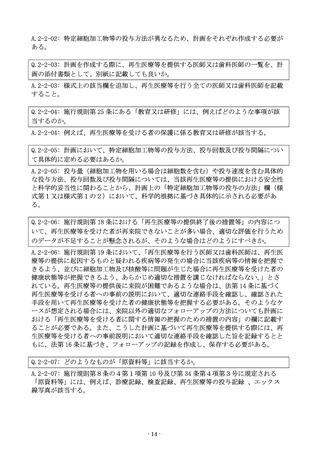
A.4-1-06: 認定を受けることができない。法第 39 条において、「外国において、本邦に
おいて行われる再生医療等に用いられる特定細胞加工物等の製造をしようとする者は、
厚生労働省令で定めるところにより、特定細胞加工物等製造施設ごとに、厚生労働大臣
の認定を受けることができる。」とされており、日本国内で再生医療等に用いるために
特定細胞加工物等の製造を行うことを目的としていない場合には、認定を受けることは
できない。
Q.4-1-07: 特定核酸等を製造する場合に、その製造工程を複数の施設で実施する必要が
ある場合は、すべての施設について特定細胞加工物等製造施設の届出、許可又は認定が
必要か。
A.4-1-07: 特定核酸等を製造する工程に関わるすべての施設について必要である。
Q.4-1-08: 特定核酸等を用いた医療を提供することを目的に特定核酸等を製造しようと
する者は、特定細胞加工物等製造施設に関する法に基づく手続(届出・許可・認定)を
行う必要があるか。
A.4-1-08: 手続きを行う必要がある。
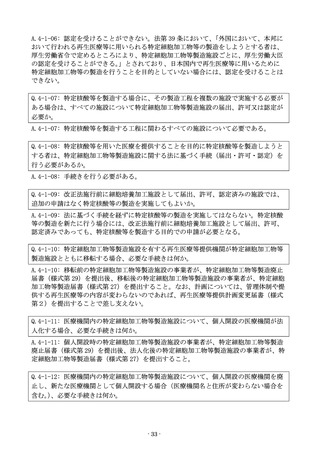
Q.4-1-09: 改正法施行前に細胞培養加工施設として届出、許可、認定済みの施設では、
追加の申請はなく特定核酸等の製造を実施してもよいか。
A.4-1-09: 法に基づく手続を経ずに特定核酸等の製造を実施してはならない。特定核酸
等の製造を新たに行う場合には、改正法施行前に細胞培養加工施設として届出、許可、
認定済みであっても、特定核酸等を製造する目的での申請が必要となる。
Q.4-1-10: 特定細胞加工物等製造施設を有する再生医療等提供機関が特定細胞加工物等
製造施設とともに移転する場合、必要な手続きは何か。
A.4-1-10: 移転前の特定細胞加工物等製造施設の事業者が、特定細胞加工物等製造廃止
届書(様式第 29)を提出後、移転後の特定細胞加工物等製造施設の事業者が、特定細胞
加工物等製造届書(様式第 27)を提出すること。なお、計画については、管理体制や提
供する再生医療等の内容が変わらないのであれば、再生医療等提供計画変更届書(様式
第2)を提出することで差し支えない。
Q.4-1-11: 医療機関内の特定細胞加工物等製造施設について、個人開設の医療機関が法
人化する場合、必要な手続きは何か。
A.4-1-11: 個人開設時の特定細胞加工物等製造施設の事業者が、特定細胞加工物等製造
廃止届書(様式第 29)を提出後、法人化後の特定細胞加工物等製造施設の事業者が、特
定細胞加工物等製造届書(様式第 27)を提出すること。
Q.4-1-12: 医療機関内の特定細胞加工物等製造施設について、個人開設の医療機関を廃
止し、新たな医療機関として個人開設する場合(医療機関名と住所が変わらない場合を
含む。)、必要な手続きは何か。
- 33 -
おいて行われる再生医療等に用いられる特定細胞加工物等の製造をしようとする者は、
厚生労働省令で定めるところにより、特定細胞加工物等製造施設ごとに、厚生労働大臣
の認定を受けることができる。」とされており、日本国内で再生医療等に用いるために
特定細胞加工物等の製造を行うことを目的としていない場合には、認定を受けることは
できない。
Q.4-1-07: 特定核酸等を製造する場合に、その製造工程を複数の施設で実施する必要が
ある場合は、すべての施設について特定細胞加工物等製造施設の届出、許可又は認定が
必要か。
A.4-1-07: 特定核酸等を製造する工程に関わるすべての施設について必要である。
Q.4-1-08: 特定核酸等を用いた医療を提供することを目的に特定核酸等を製造しようと
する者は、特定細胞加工物等製造施設に関する法に基づく手続(届出・許可・認定)を
行う必要があるか。
A.4-1-08: 手続きを行う必要がある。
Q.4-1-09: 改正法施行前に細胞培養加工施設として届出、許可、認定済みの施設では、
追加の申請はなく特定核酸等の製造を実施してもよいか。
A.4-1-09: 法に基づく手続を経ずに特定核酸等の製造を実施してはならない。特定核酸
等の製造を新たに行う場合には、改正法施行前に細胞培養加工施設として届出、許可、
認定済みであっても、特定核酸等を製造する目的での申請が必要となる。
Q.4-1-10: 特定細胞加工物等製造施設を有する再生医療等提供機関が特定細胞加工物等
製造施設とともに移転する場合、必要な手続きは何か。
A.4-1-10: 移転前の特定細胞加工物等製造施設の事業者が、特定細胞加工物等製造廃止
届書(様式第 29)を提出後、移転後の特定細胞加工物等製造施設の事業者が、特定細胞
加工物等製造届書(様式第 27)を提出すること。なお、計画については、管理体制や提
供する再生医療等の内容が変わらないのであれば、再生医療等提供計画変更届書(様式
第2)を提出することで差し支えない。
Q.4-1-11: 医療機関内の特定細胞加工物等製造施設について、個人開設の医療機関が法
人化する場合、必要な手続きは何か。
A.4-1-11: 個人開設時の特定細胞加工物等製造施設の事業者が、特定細胞加工物等製造
廃止届書(様式第 29)を提出後、法人化後の特定細胞加工物等製造施設の事業者が、特
定細胞加工物等製造届書(様式第 27)を提出すること。
Q.4-1-12: 医療機関内の特定細胞加工物等製造施設について、個人開設の医療機関を廃
止し、新たな医療機関として個人開設する場合(医療機関名と住所が変わらない場合を
含む。)、必要な手続きは何か。
- 33 -