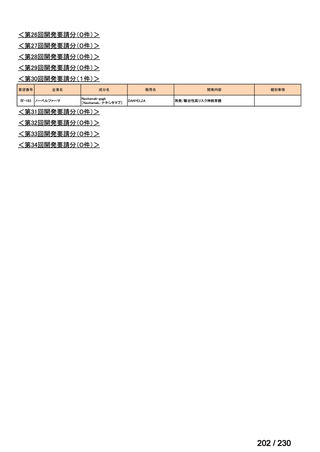
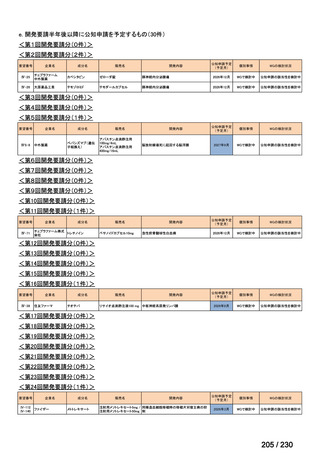
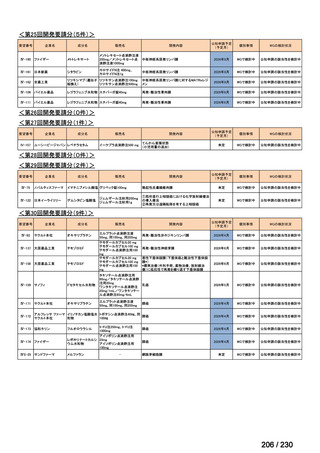
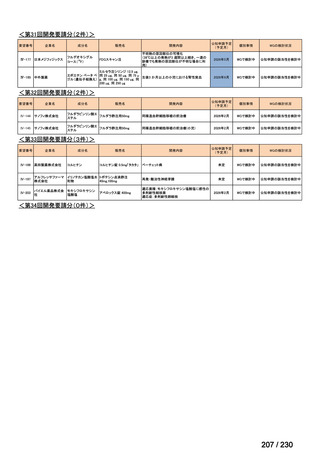
会議資料 (95 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00045.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第67回 2/6)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
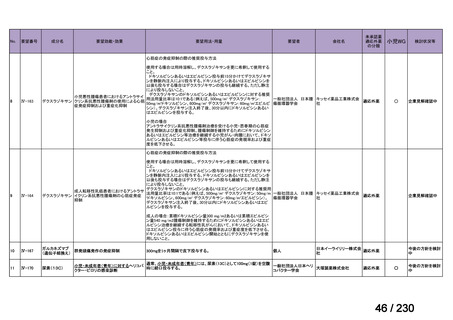
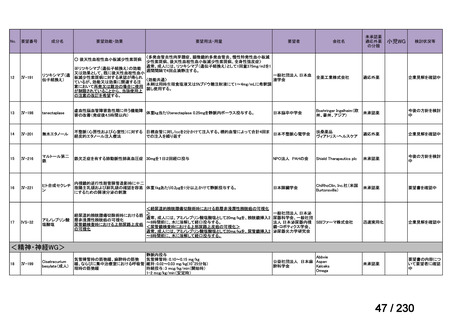
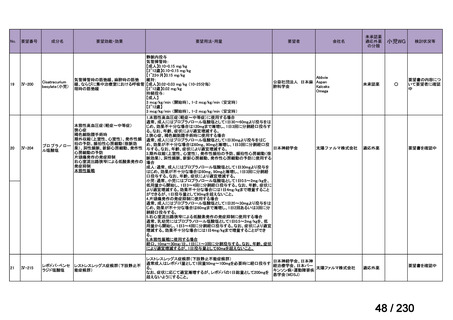
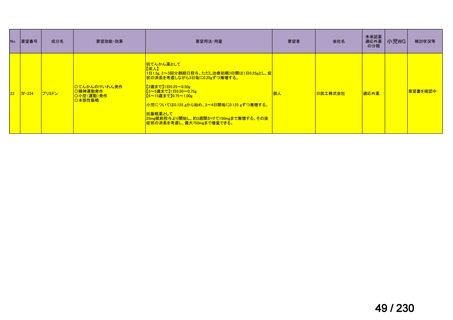
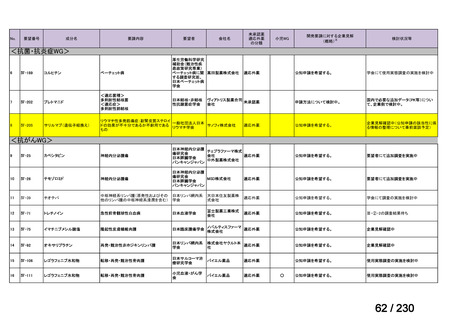
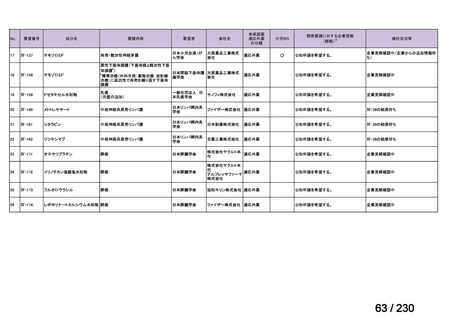
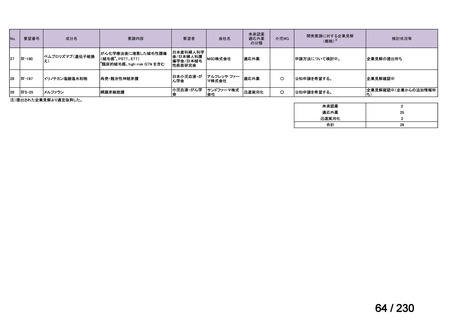
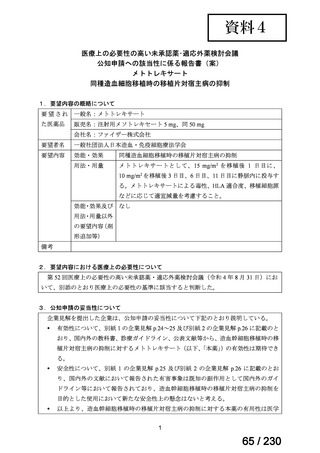
要望番号;IV-112
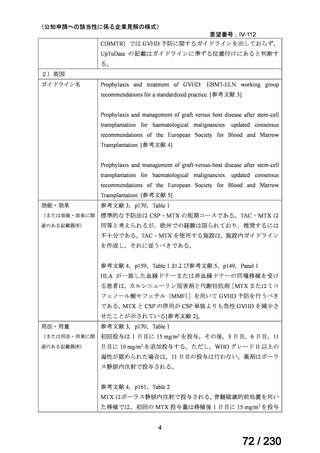
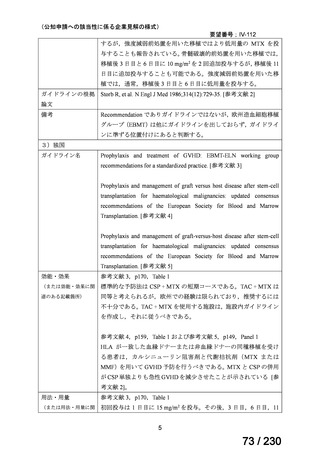
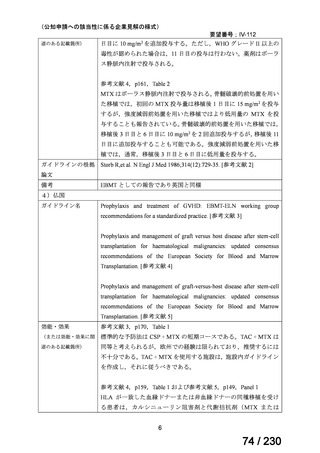
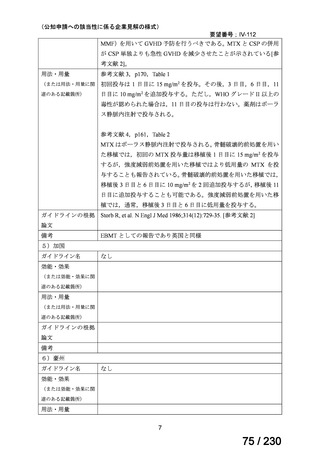
の記載および臨床試験成績の報告等も踏まえ,用法・用量および用法及び用量に関連する
注意を以下のとおり設定することが妥当と考える。
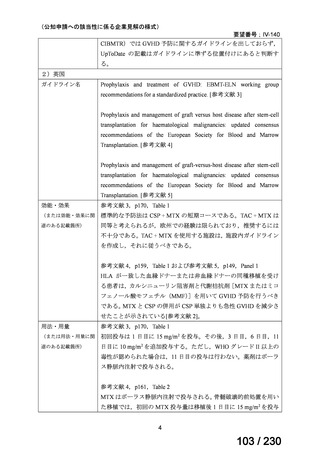
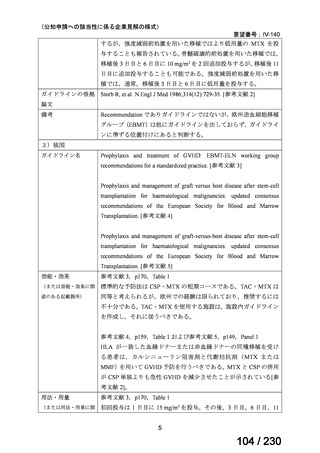
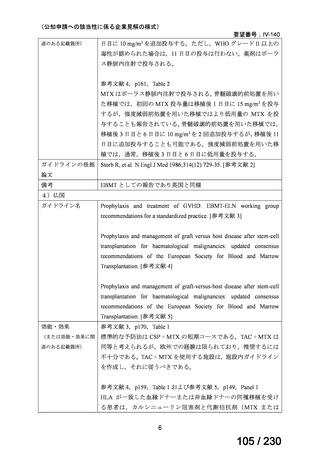
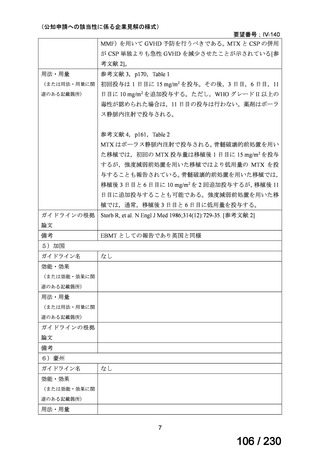
【用法・用量】
メトトレキサートとして,15 mg/m2 を移植後 1 日目に,10 mg/m2 を移植後 3 日目,6 日目,
11 日目に静脈内に投与する。患者の状態に応じて適宜減量する。
用法及び用量に関連する注意
造血幹細胞移植時の移植片対宿主病の抑制に本剤を使用する際の本剤の投与量や免疫抑制
剤との併用については診療ガイドライン等の最新の情報を参照すること。
(3)上記(1)及び(2)以外の添付文書の記載内容について
1)国内外の添付文書の記載内容(注意喚起等)の異同について
海外で承認されていないため,該当しない。
2)上記1)以外で本邦の添付文書上で改訂が必要と考えられる箇所の有無について
改訂が必要な箇所はないと考える。
9.要望内容に係る更なる使用実態調査等の必要性について
(1)要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点
の有無について
6(2)のとおり,同種造血細胞移植時の GVHD の抑制を目的とした本剤の用法・用量を
評価する使用実態調査が実施されており,不足している点は無いと考える。
(2)上記(1)で臨床使用実態が不足している場合は、必要とされる使用実態調査等の内
容について
該当しない。
(3)その他、製造販売後における留意点について
該当しない。
10.備考
特になし
27
95 / 230