会議資料 (137 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00045.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第67回 2/6)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
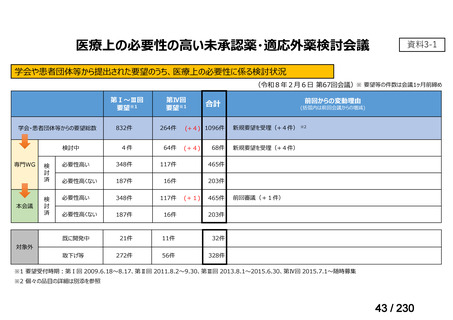
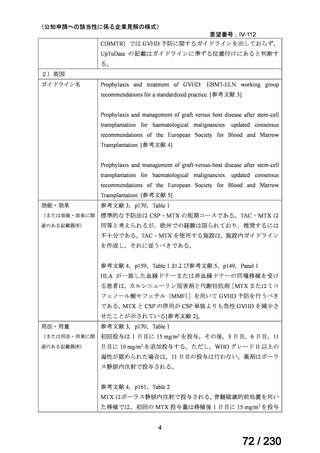
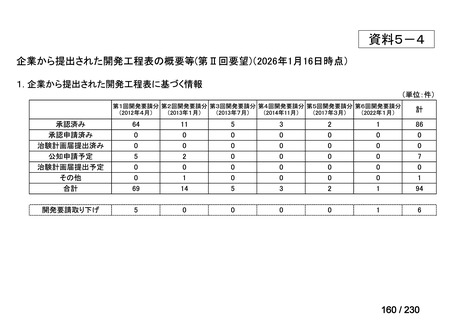
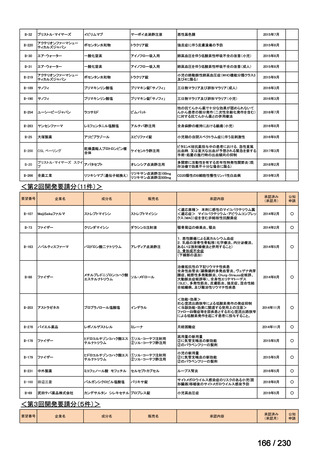
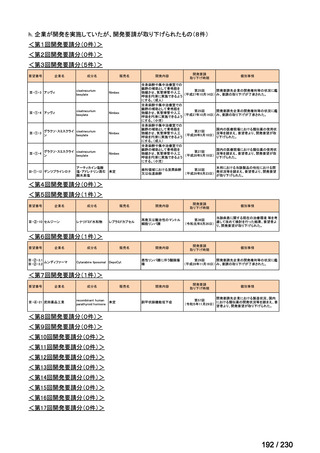
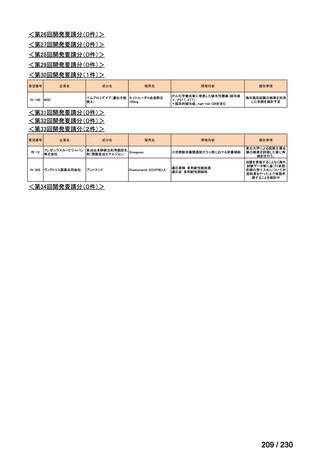
前回会議からの進捗は以下のとおり。
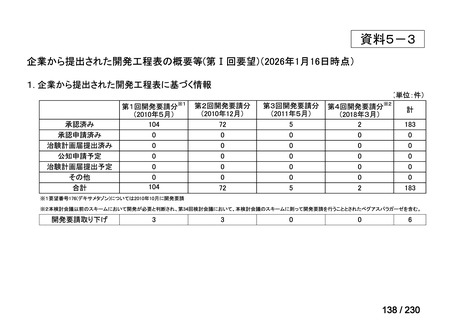
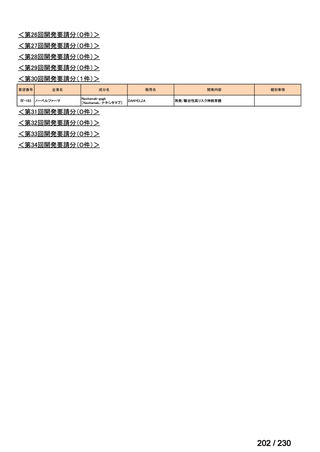
⑴ 第Ⅰ回要望
前回資料からの変更なし。
⑵ 第Ⅱ回要望
前回資料からの変更なし。
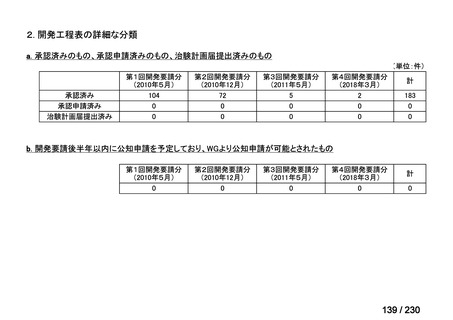
⑶ 第Ⅲ回要望
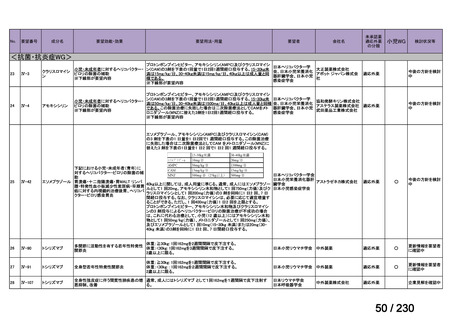
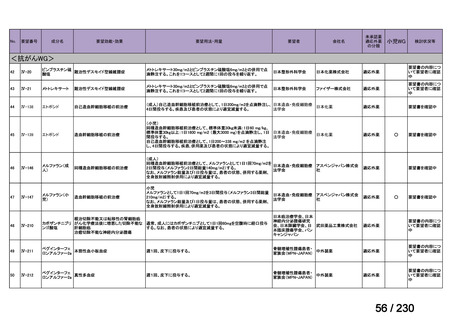
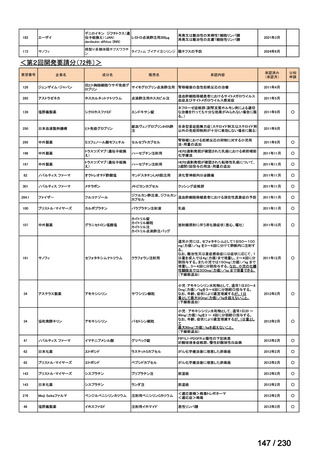
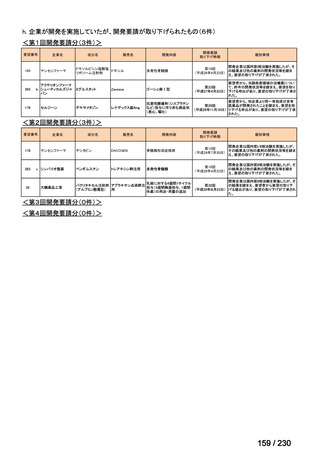
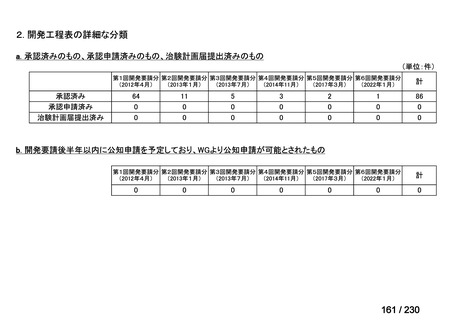
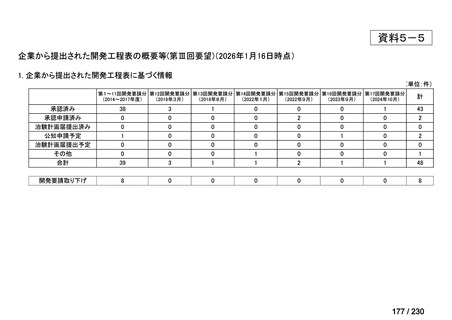
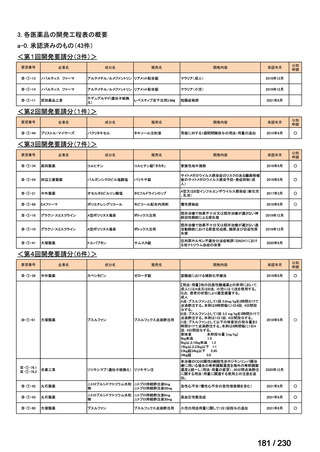
承認済み品目が、1件増え、43 件
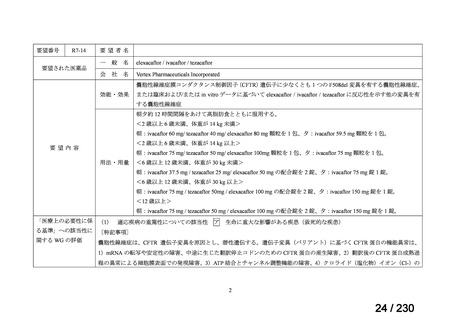
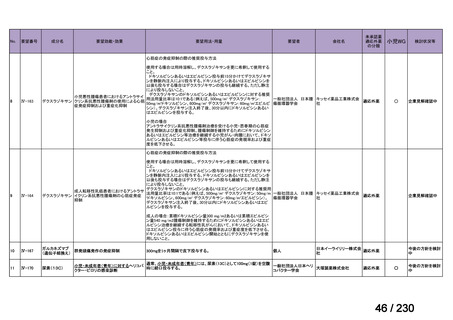
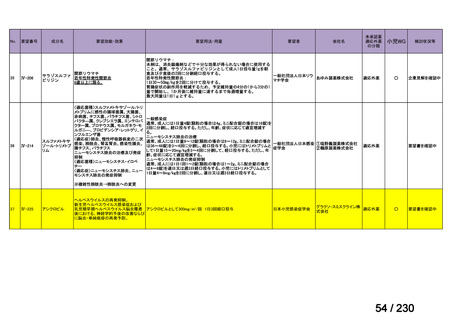
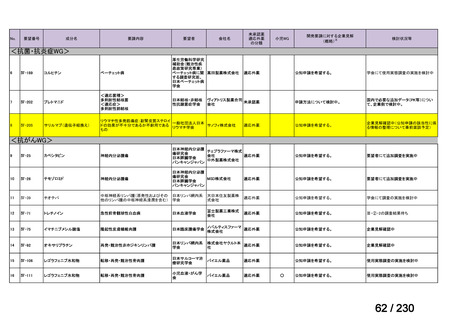
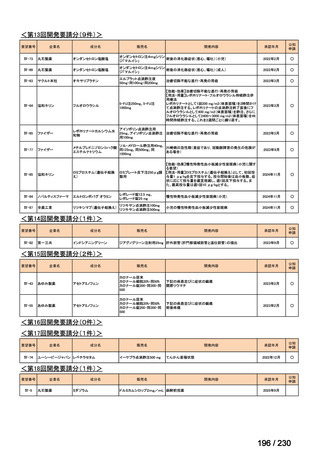
要望番号
企業名
成分名
販売名
開発内容
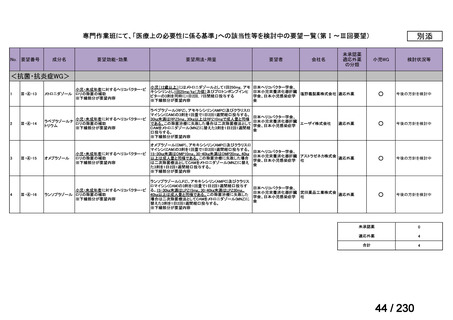
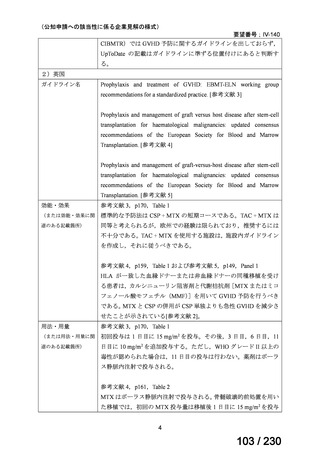
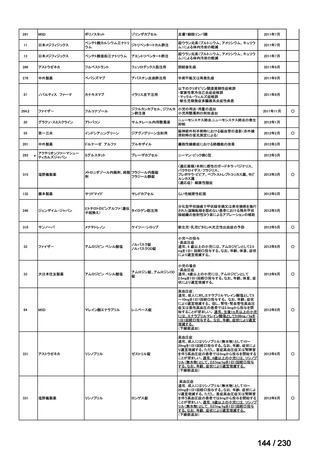
Ⅲ-④-12
ファイザー
メトロニダゾール
アネメトロ点滴静注液 500mg
嫌気性菌感染症、感染性腸炎、アメ
ーバ赤痢
承認申請済み
→承認済み
(小児の用量の追加)
(2025 年 11 月)
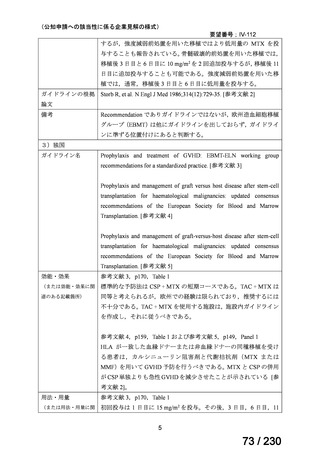
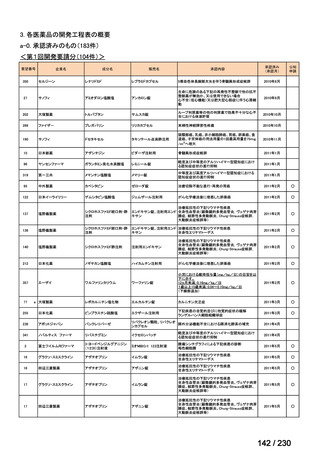
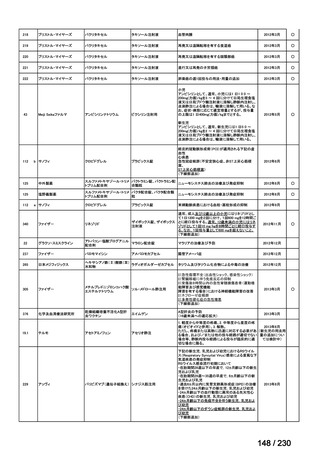
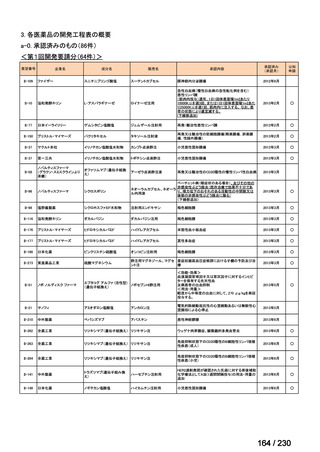
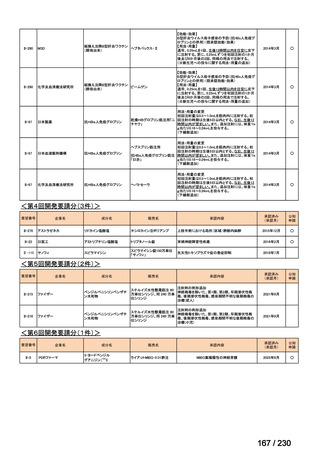
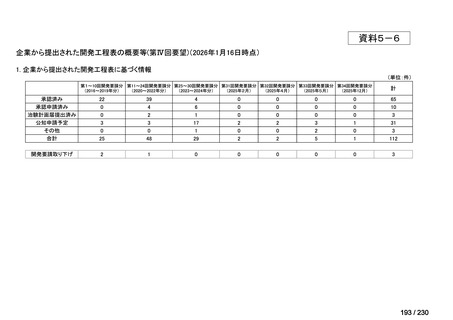
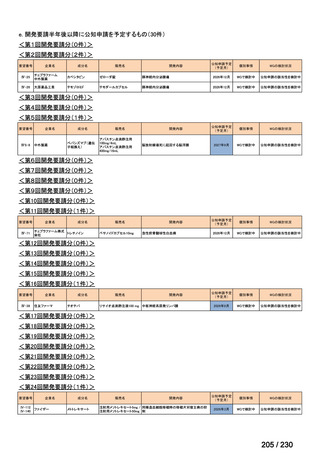
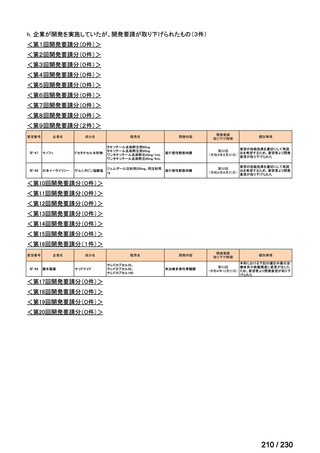
⑷
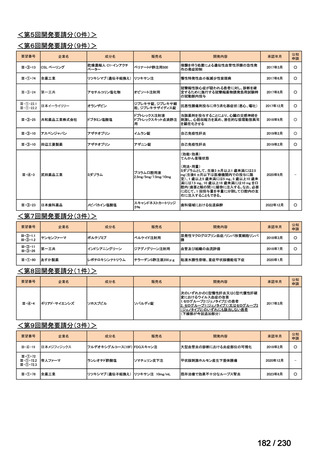
第Ⅳ回要望
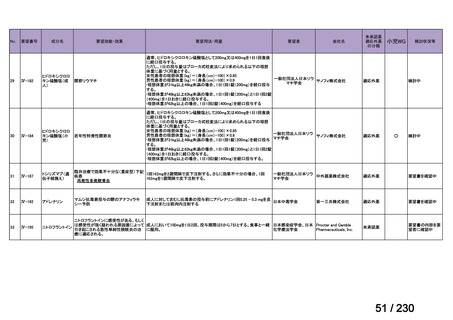
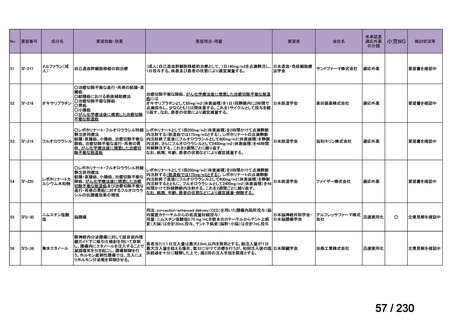
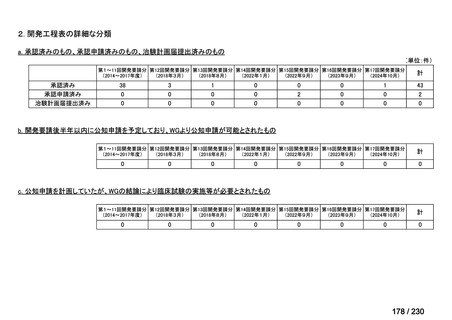
承認申請済み品目が、1件増え、10 件
公知申請予定品目が、1件増え、31 件
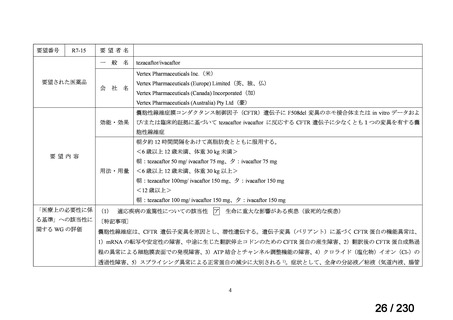
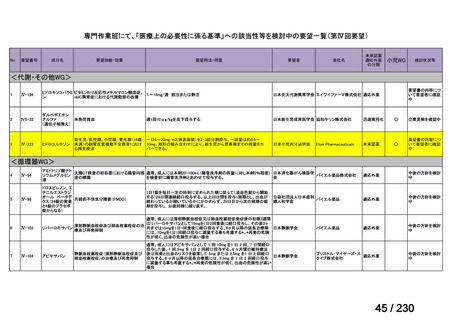
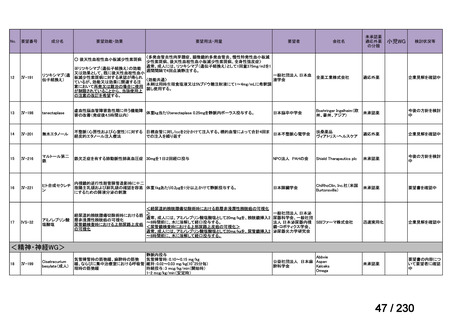
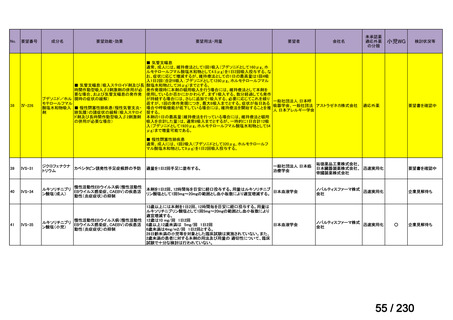
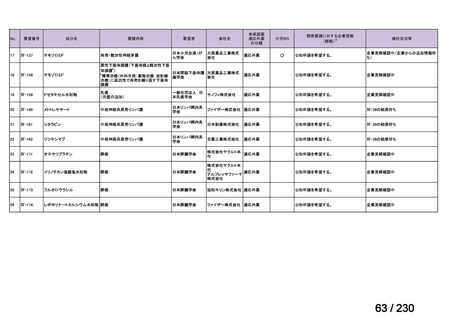
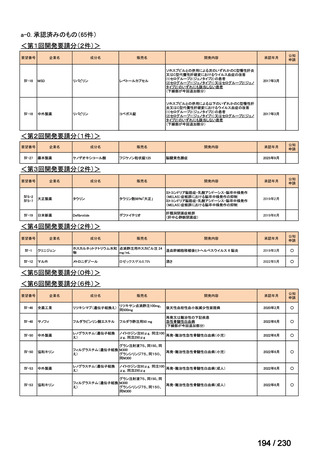
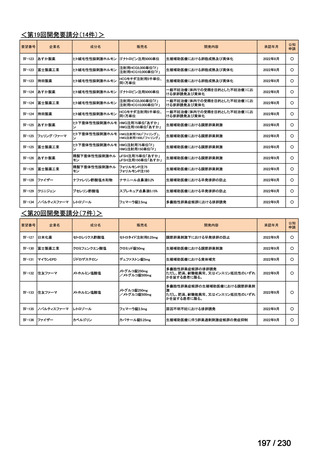
要望番号
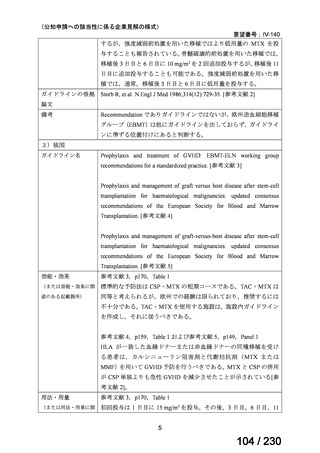
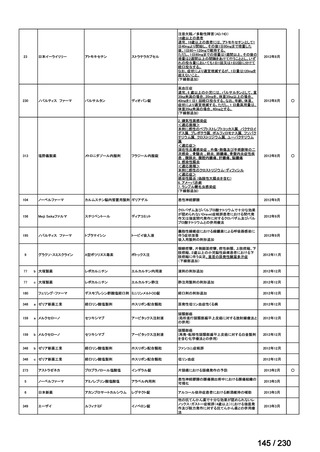
Ⅳ-83
企業名
サノフィ
成分名
アレムツズマブ
販売名
マブキャンパス点滴静注 30mg
開発内容
T 細胞性前リンパ球性白血病
(遺伝子組換え)
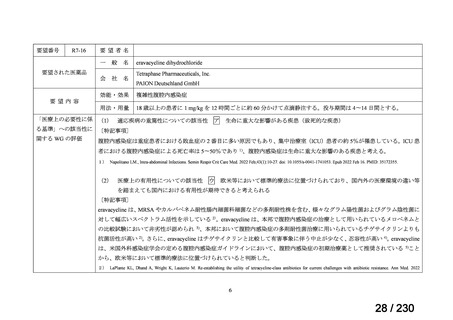
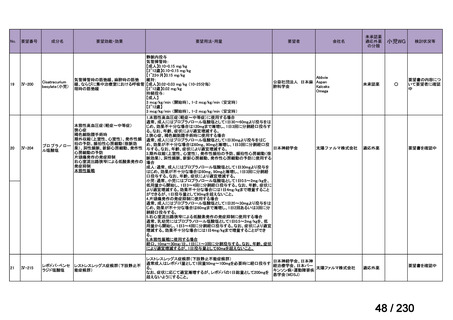
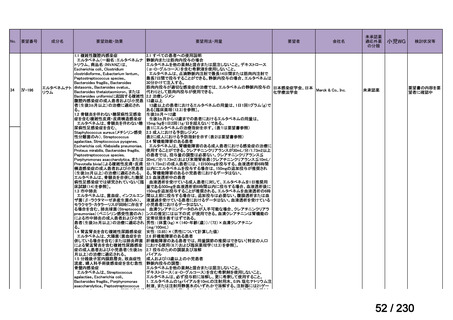
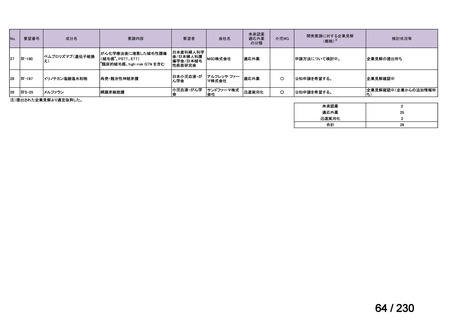
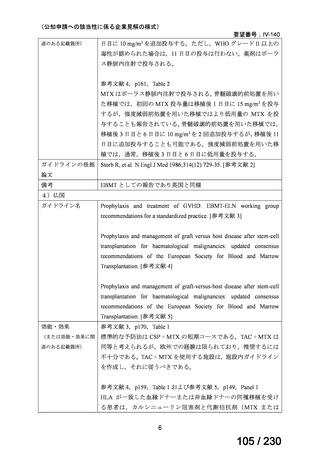
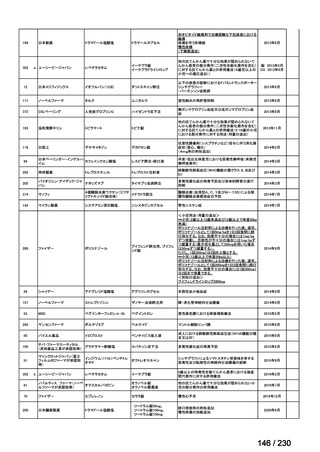
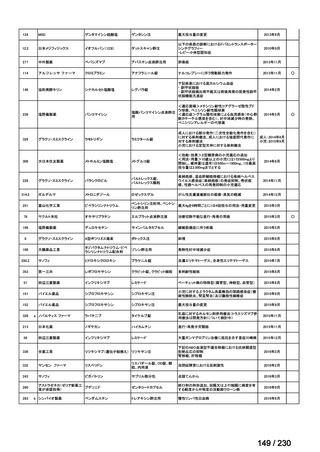
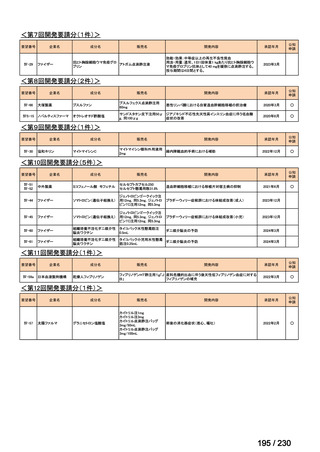
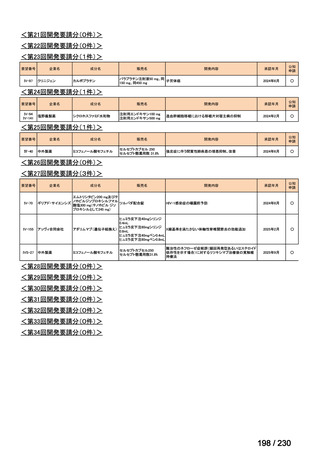
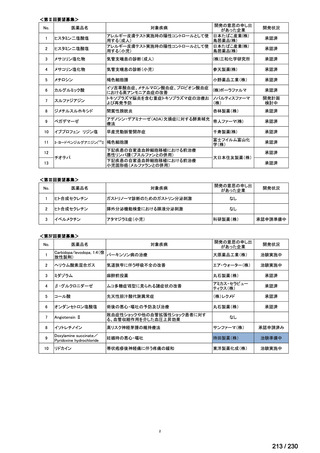
Ⅳ-205
進捗内容
サノフィ
サリルマブ(遺伝
子組換え)
進捗内容
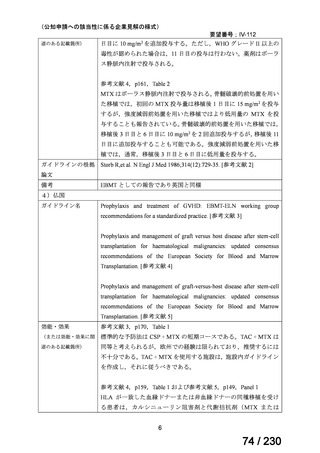
公知申請予定
→承認申請済み
(2025 年 11 月)
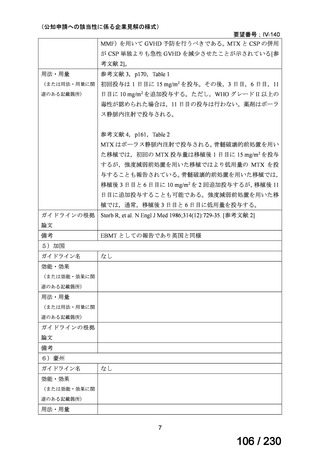
ケブザラ皮下注 200mg シリン
ジ、ケブザラ皮下注 200mg オ
ートインジェクター
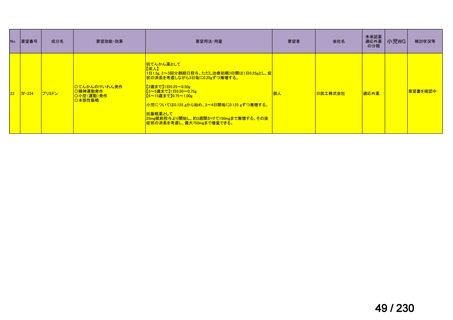
リウマチ性多発筋痛症:副腎皮質ス
テロイドの効果が不十分であるか不
耐容であるもの
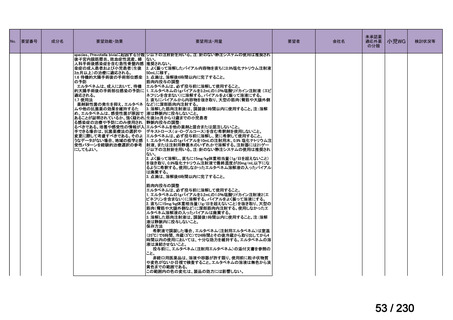
開発要請発出に伴
い、公知申請予定と
して追加
137 / 230