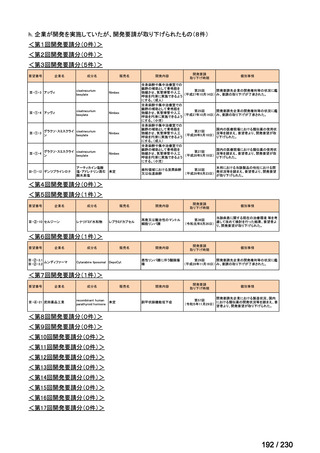
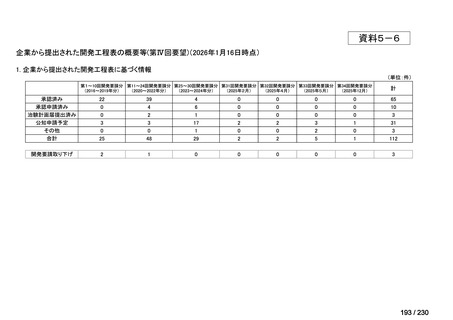
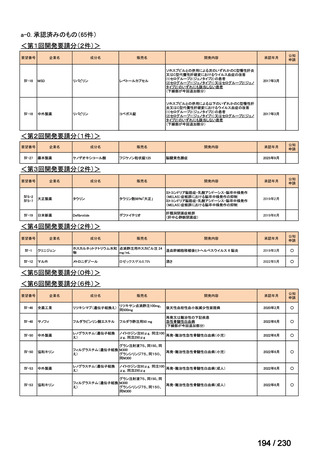
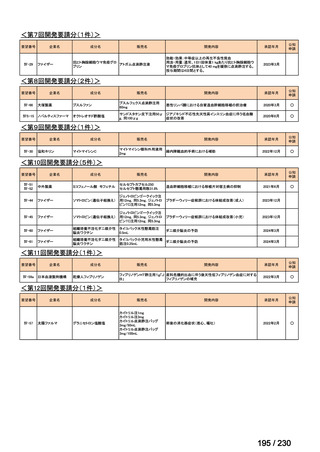
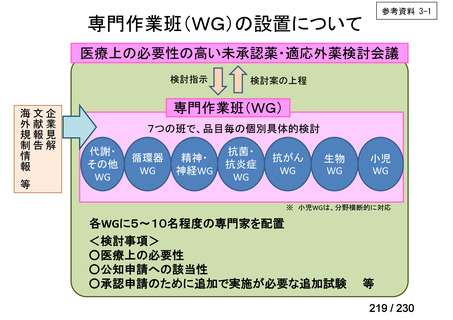
会議資料 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00045.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第67回 2/6)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
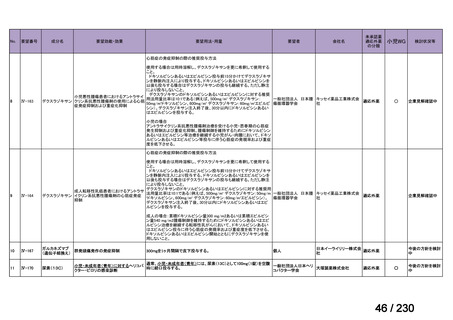
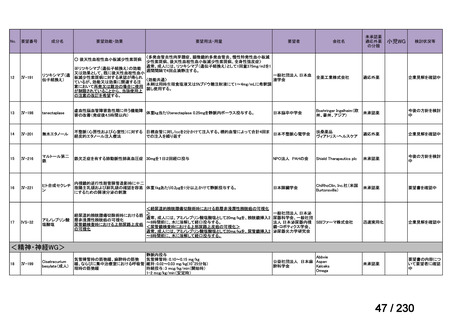
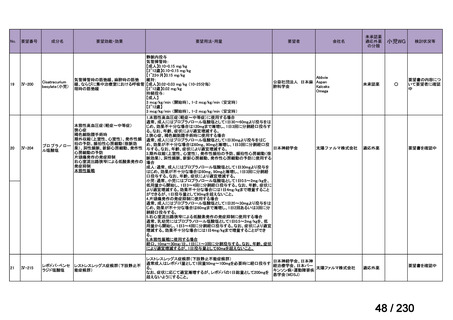
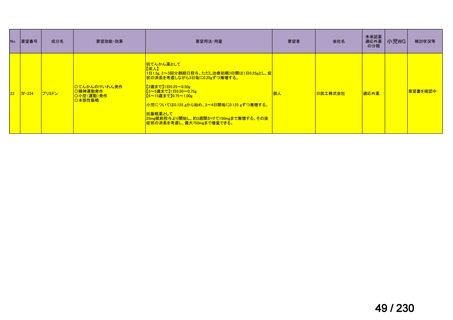
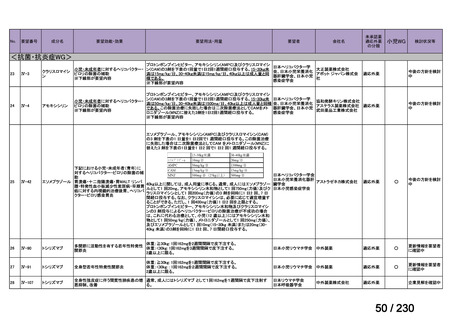
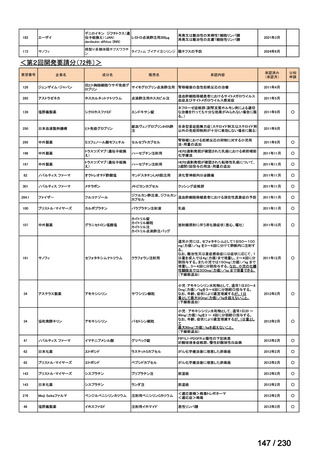
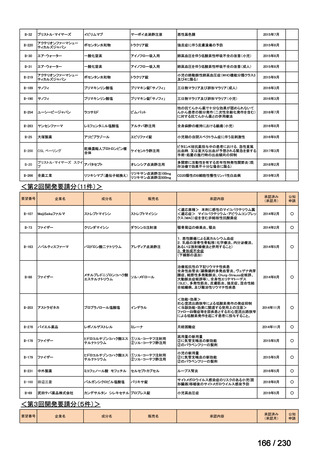
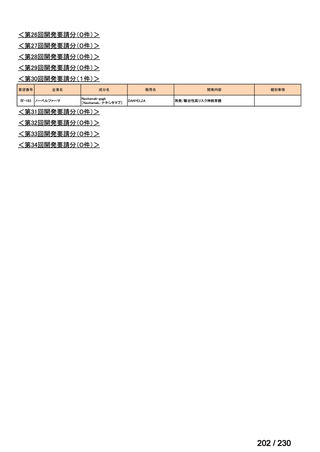
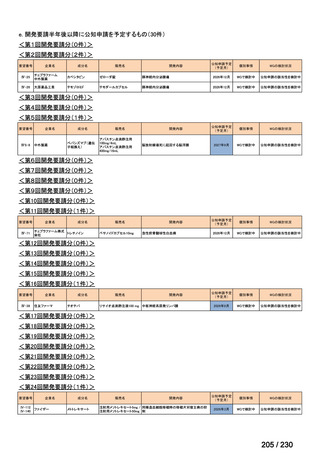
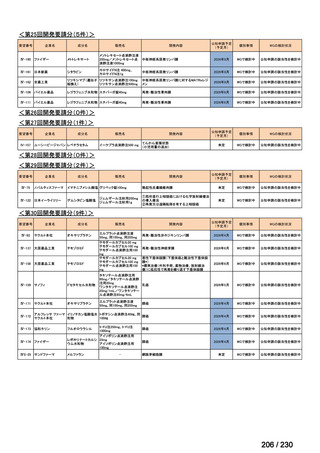
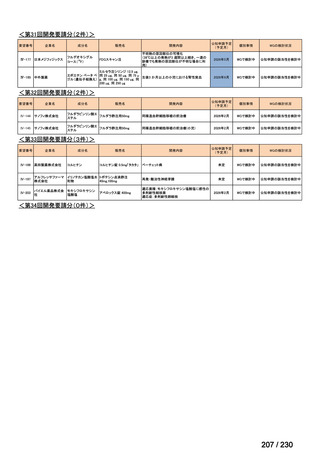
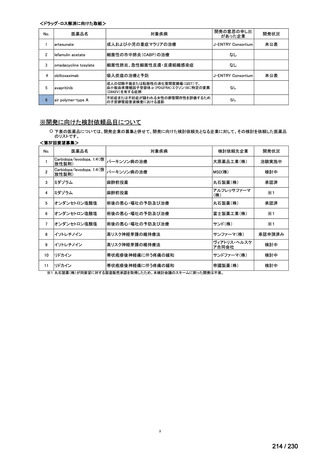
R7-9
要望された医薬品
要望者名
一
般
名
telotristat etiprate
会
社
名
TerSera Therapeutics(米)
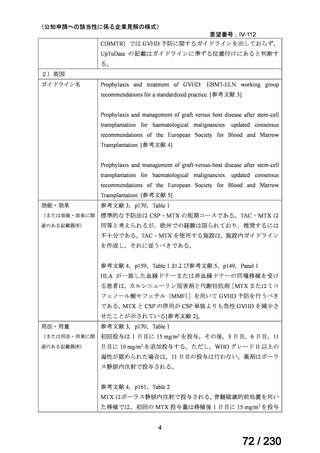
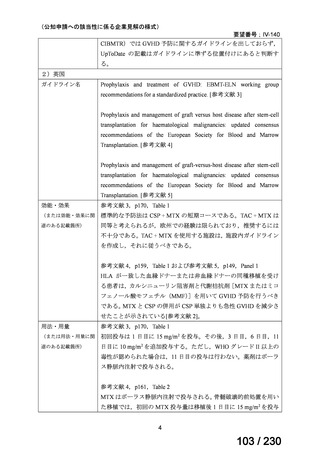
効能・効果
ソマトスタチンアナログ(SSA)療法ではコントロールが不十分なカルチノイド症候群による下痢
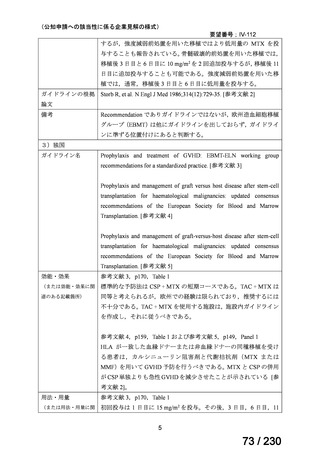
用法・用量
250 mg を 1 日 3 回、食後に経口投与する。
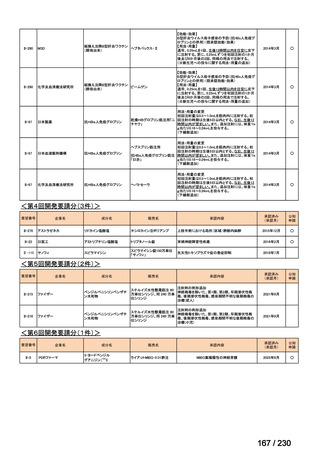
要望内容
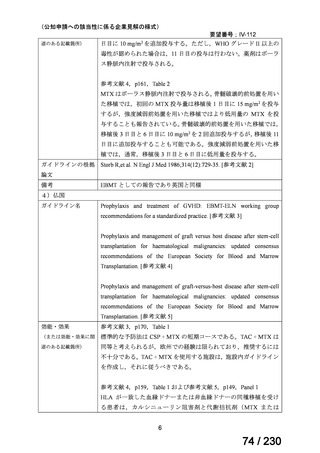
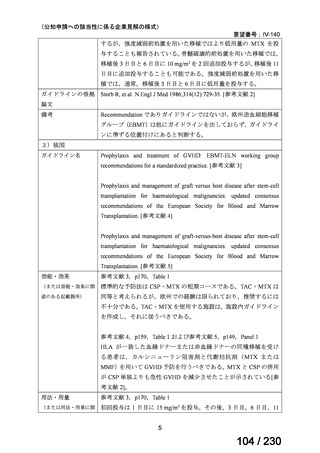
「医療上の必要性に係 (1) 適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ウ
その他日常生活に著しい影響を及ぼす疾患
カルチノイド症候群による下痢は神経内分泌腫瘍に随伴する慢性症状であり、標準治療(ソマトスタチンアナログ(SSA)製剤)
で十分にコントロールできない患者が存在する 1)。その場合、症状は進行性かつ難治性で、身体的・社会的機能を著しく阻害す
ると考える。
1) Gade AK, Olariu E, Douthit NT. Carcinoid Syndrome: A Review. Cureus. 2020 Mar 5;12(3):e7186. doi: 10.7759/cureus.7186. PMID: 32257725.
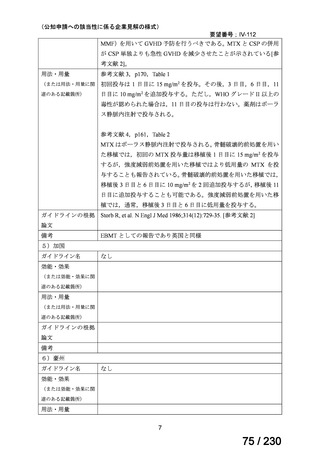
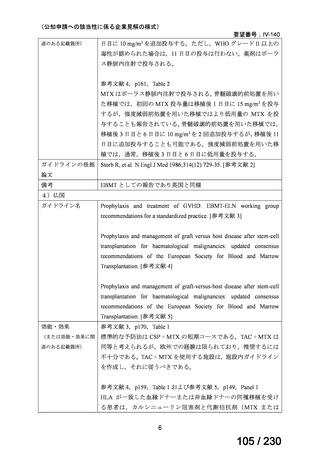
(2) 医療上の有用性についての該当性
ウ
欧米等において標準的療法に位置づけられており、国内外の医療環境の違い等
を踏まえても国内における有用性が期待できると考えられる
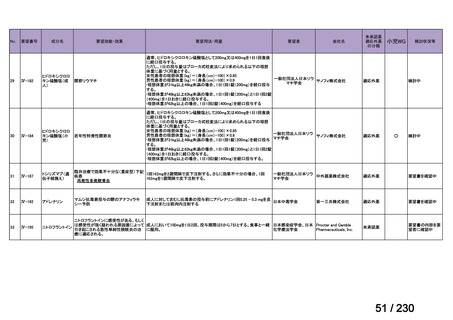
〔特記事項〕
カルチノイド症候群に伴う下痢の治療においては、SSA が標準治療に位置づけられているが、SSA 投与にもかかわらず下痢症状
が持続する症例が存在することが示されており 1)、SSA 単独による症状コントロールが不十分な患者が一定割合で存在すること
が考えられる。Telotristat etiprate は、カルチノイド症候群に伴う下痢が SSA で十分にコントロールできない患者に対して、SSA
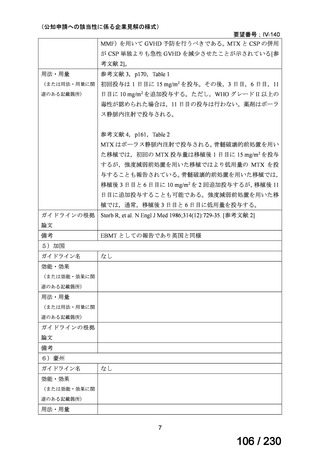
への上乗せで、
プラセボに対する排便回数の有意な減少が報告されており、
重篤な有害事象の頻度も限定的である 2)。米国 National
Comprehensive Cancer Network ガイドラインでは、SSA 不応例に対する選択肢として記載されている 3)。以上を踏まえると、有効
性、及び患者の負担軽減の観点から、本剤は医療上の有用性が期待できると判断した。
4
12 / 230