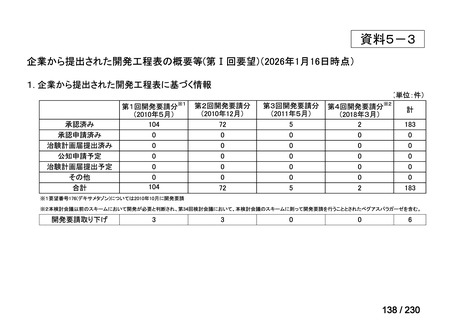
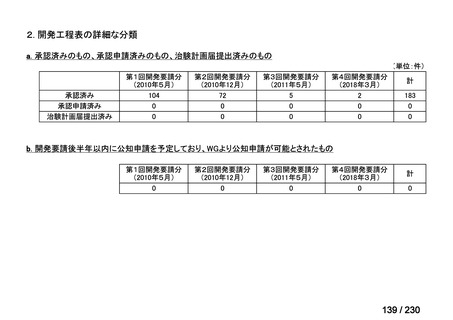
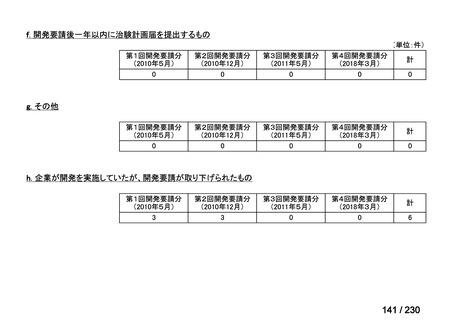
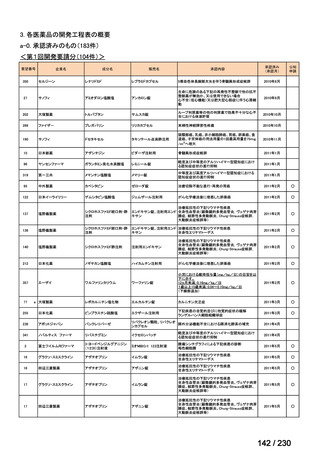
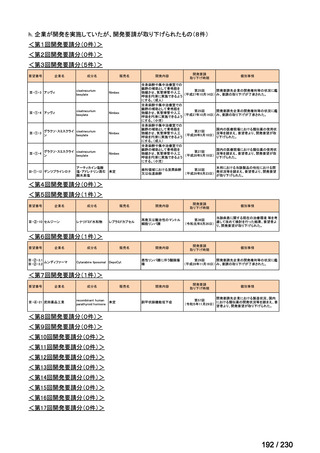
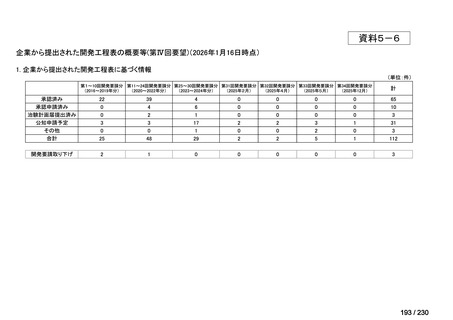
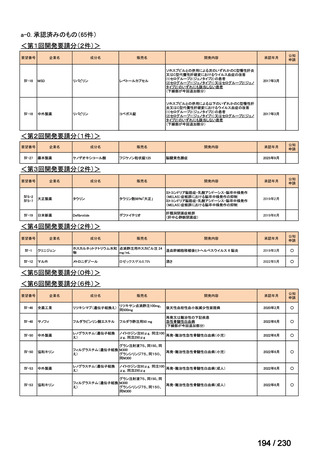
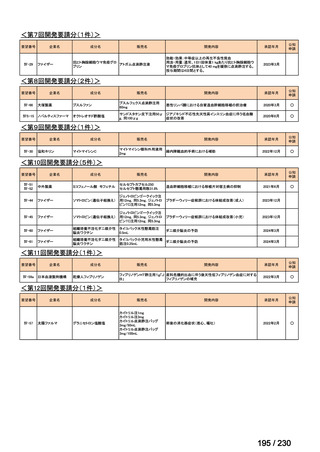
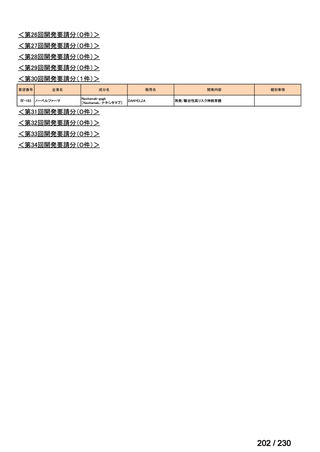
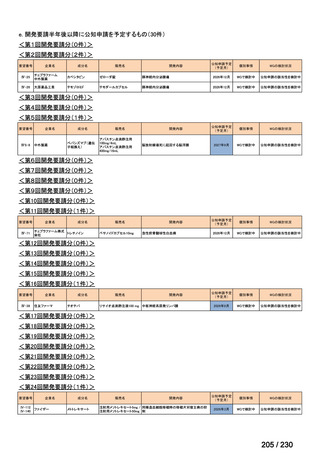
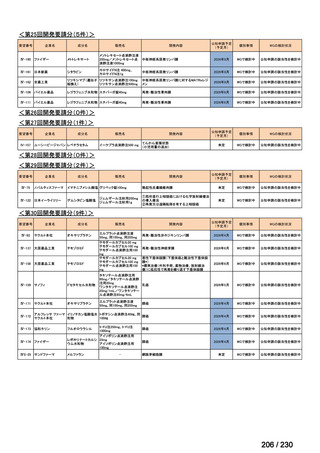
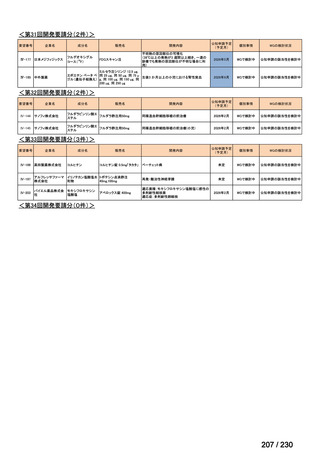
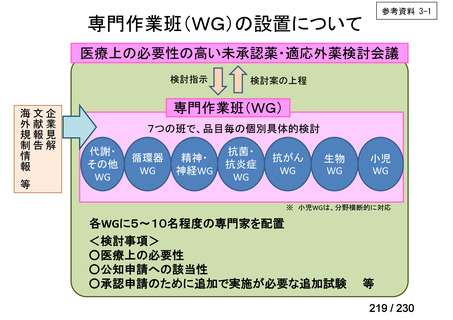
会議資料 (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00045.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第67回 2/6)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
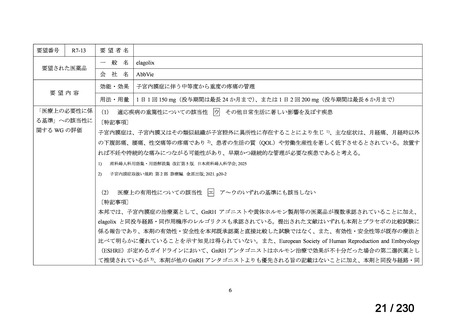
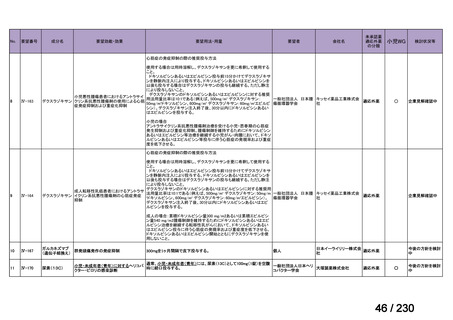
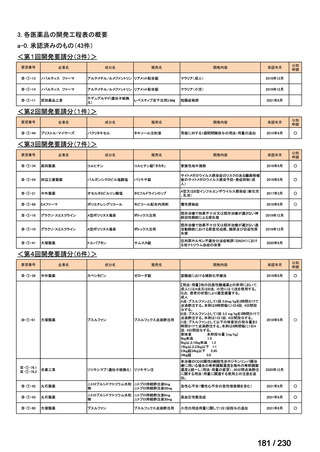
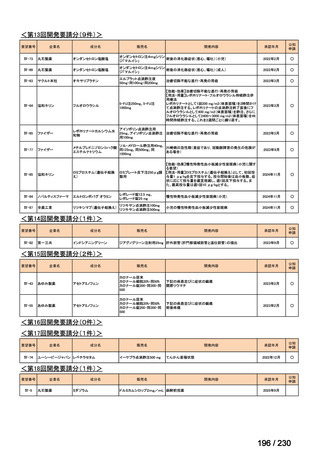
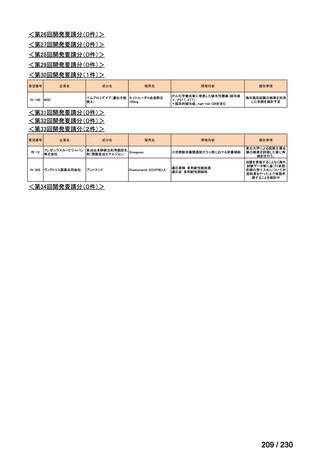
R7-19
要望者名
一
般
名
ripretinib
Deciphera Pharmaceuticals, LLC(米、英、独、仏)
要望された医薬品
会
社
名
Medison Pharma Canada Inc.(加)
Specialised Therapeutics PM Pty Ltd(豪)
効能・効果
要望内容
用法・用量
イマチニブを含む 3 種類以上のキナーゼ阻害剤による治療歴のある進行性消化管間質腫瘍(GIST)の成人患者の
治療
150 mg を 1 日 1 回、経口投与する。
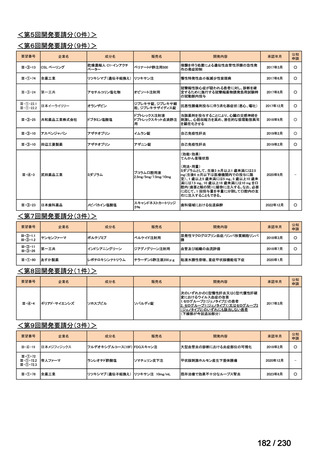
「医療上の必要性に係 (1) 適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
生命に重大な影響がある疾患(致死的な疾患)
切除不能な消化管間質腫瘍(以下、
「GIST」)の生存期間中央値は 3.9 年 1)である等、生命に重大な影響がある疾患と判断した。
1) 七島篤志, 赤澤祐子, 石原立, et al., 消化器難治癌シリーズ GIST(消化管間質腫瘍).一般財団法人日本消化器病学会.2025 年 4 月.[Online] Available from:
https://www.jsge.or.jp/committees/intractable_cancer/pdf/GIST.pdf.
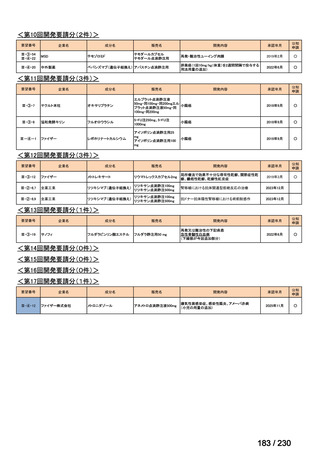
(2) 医療上の有用性についての該当性
ウ
欧米等において標準的療法に位置づけられており、国内外の医療環境の違い等
を踏まえても国内における有用性が期待できると考えられる
〔特記事項〕
ripretinib は、NCCN ガイドラインにおいて、イマチニブメシル酸塩(以下、
「イマチニブ」)
、スニチニブリンゴ酸塩(以下、
「ス
ニチニブ」)
、レゴラフェニブ水和物(以下、
「レゴラフェニブ」)等による治療後に疾患進行が認められた切除不能な GIST に対
する四次治療として推奨されている 2)。本邦では、イマチニブ、スニチニブ及びレゴラフェニブによる治療歴のある GIST に対
してピミテスピブが承認されている。ピミテスピブは HSP90 を阻害することにより、腫瘍の増殖に関与するタンパクの発現量の
減少、アポトーシスの誘導等を介して腫瘍増殖抑制作用を示す一方、ripretinib はチロシンキナーゼを阻害することにより腫瘍増
2
34 / 230