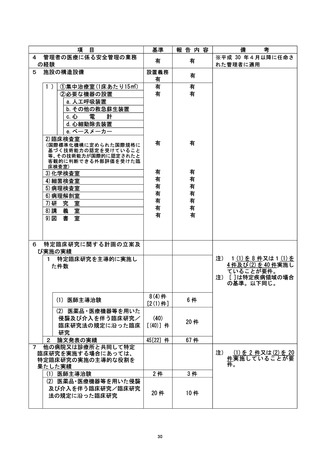
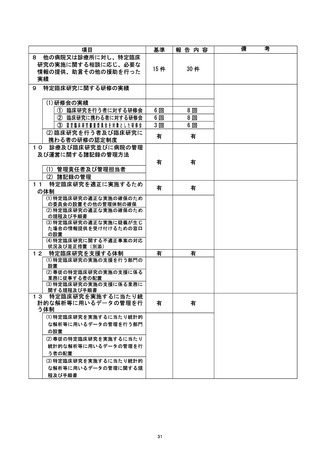
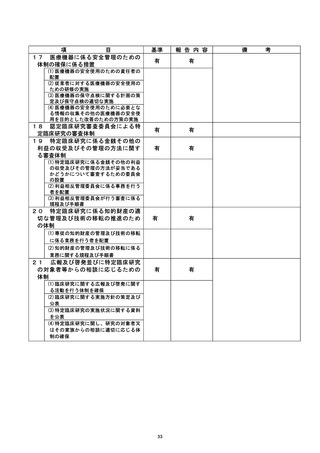
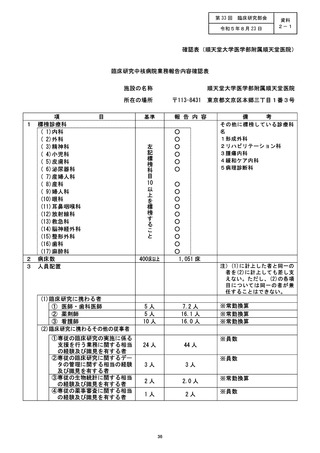
資料2:臨床研究中核病院業務報告内容確認表 (79 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
同意取得の不備
2021 年 12 月 24 日に実施されたモニタリングにおいて、20 例の同意文書原本の保管
が確認できなかったと報告された。
不適正事棄に関する対応状況 :
2021年12月24日に実施されたモニタリングにおいて、20例の同意文書原本の保管が
確認できなかったと報告された。不適合の発生原因として、2014年に外来棟の引っ越
し、2021年に研究室の引っ越しが実施されたことにより、同意文書の保管場所が変更
されたためと考えられた。
実際は20例のうち15例の同意文書が臨床試験部で保管されており、残りの1例につい
ては当該診療科において保管されていたことが後日確認された。したがって、結果的
に同意文書が確認できなかった症例は4例であった。何れの症例についても同意は取得
しているが、同意文書を紛失したものである。しかし、その旨が研究代表医師へ報告
されたのはデータベースの固定 (2022年1月13日) 後であったことから、20例全例が解
析対象集団から除外された。
臨床研究全体としての対応状況は次のとおりである。
本多施設共同研究では、2021年8月11日から2022年1月13日までに全施設においてモ
ニタリングによる確認を行っている。その結果、当院以外の施設でも重大な不適合が
複数件発生にており、「重大な不適合報告書 (2022年1月26日) 」が2022年3月3日に認
定臨床研究審査委員会 (CRB) によって審議され、継続審査となった。そのことに関し
て、4月22日及び4月28日に研究者会議が開催され、本研究参加施設の研究者に共有さ
れた。また、 今後の対応について協議し、以下の基本方針について合意を得た。
・ 重大な不適合が認められた各施設において、当該不適合の原因を特定する。
・ 重大な不適合が認められた各施設において、当該不適合の再発防止策を確認する
・認められた重大な不適合のうち、解析対象集団から除外された研究対象者に対し
て、各施設において文書による丁和芳な説明 (対面または文書送付) を行う。
是正措置 :
2022年6月2日のCRB審議により、追加の対応 (発生原因の深堀、教育のみにとどまら
ない具体的な再発防止策、不適合の説明に対する研究対象者の反応の報告など) が求
められ、現在も各施設で対応が継続中である。
当院においては、同意書原本が保管されていなかった4例について、改めて文書によ
る同意が取得されている (2022年4月20日5月11日) 。再発防止策として、当院が主
導する試験については、
2015年以降データセンターでRisk Based Approach (RBA) に基づく品質管理活動をし
ており、同意文書の確認を実施している。外部の機関が主体となって実施する研究に
ついてもRBAに基づく品質管理活動を行うことを求めていくことを検討している。
79