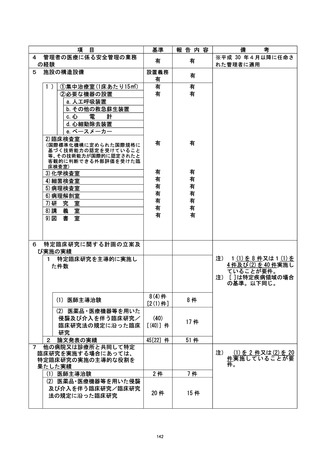
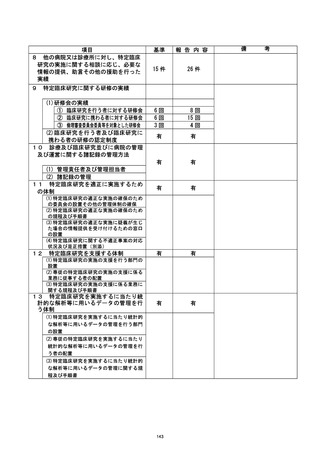
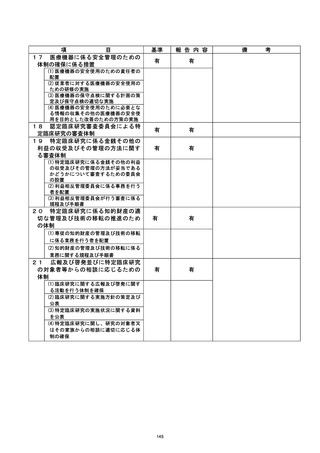
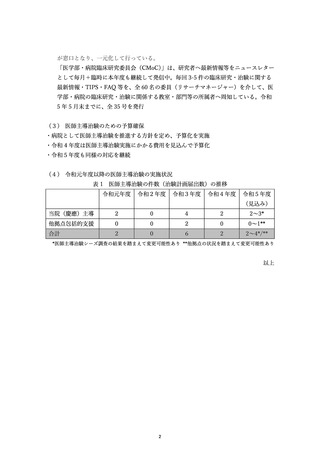
資料2:臨床研究中核病院業務報告内容確認表 (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
され、7月2日CRBにて承認された。
(先進医療 B : 多機関共同研究[他機関主導]、他機関 CRB)
不適正事案に関する対応状況 :
2021年7月2日、研究代表医師からCRBへ「不適合に関する報告書(2021年7月1日)」が提
出され、再発防止策として只体的な研究期間の記載、参加機関の会議による情報共有
、新規候補対象者の登録スケジュールのダブルチェックの3点が示され、2021年7月2日
にCRBにて承認された。
7月27日、当院研究責任医師から「了臨床研究に関する不適合報告書(202{年7月21日) 」
が当院管理者に提出され、再発予防措置として参加施設との定期的な情報共有、モニ
タリングの実施、研究情報の再確認を行うことが報告された。
8月6日開催の臨床研究監理センター運営委員会にて承認、8月19日の臨床研究委員会運
営会議にて報告、了承された。
是正措置 :
(1 ) 研究代表医師による対応
・ 研究計画書に具体的な登録期間等を明記する。・定期的な研究者会議にて、登録期間
について共有し、期間の逸脱がないか確認する。
・ 新規登録候補者について、登録スケジュールを検討し、登録期間の逸脱がないかを複
数の研究者で確認する。
(2) 当院研究責任医師による対応
・ 参加施設の研究関係者で、定期的な情報共有を図る。
・モニタリングを実施する。
・研究情報の確認を行う必要性を周知する。
(3) 当院管理者による対応
臨床研究監理センター運営委員会および臣床研究委員会運営会議において、再発防止の
注意喚起を行った。
井 4
登録D等 | 国還清浦畔 治験・臨床研究名
不適正事案の概要 :
CRB未承認・当院未許可の同意書書式により同意を取得した。 (6名)
2021年6月29日から7月13日の間に、当院でCRB未承認・当院未許可の版の同意書書式を
使用し、研究対象者6名より同意を取得した。
なお当該5名に使用された説明文書は、CRB承認および当院許可を得た適切な版であっ
た。
発生要因として、説明文書の印刷後、別途同意書書式の印刷を行った際に、誤ってCRB
へ変更申請中 (当院未許可) の同意書を印刷し、かつ同意取得時に説明文書と同意書
の版が同一であることの確認を怠ったことが報告された。
研究責任医師は、研究対象者の人権・安全性、研究の進捗や結果の信頼性には影響は
ないが、研究対象者への再同意取得に伴う負担が生じたとの見解を示した。
(単機関研究、自機関 CRB)
不適正事案に関する対応状況 :
2021年7月27日、当院研究責任医師から「了臨床研究に関する不適合報告書(2021年7月27
日) 」が当院管理者に提出され、再発防止として説明文書・同意書の版番号の確認の徹
底、および実施許可を得た最新版であるかを確認して使用することが示された。
| 8 月 6 日開催の臨床研究監理センター運営委員会にて承認、8 月 19 日の臨床研究委員
53