資料2:臨床研究中核病院業務報告内容確認表 (58 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
時点で研究班内でミーティングを行い、有害事象の有無やプロトコールの確認を徹底す
ることが報告された。
(単機関研究、自機関 CRB)
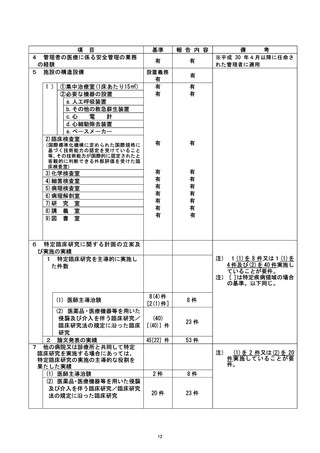
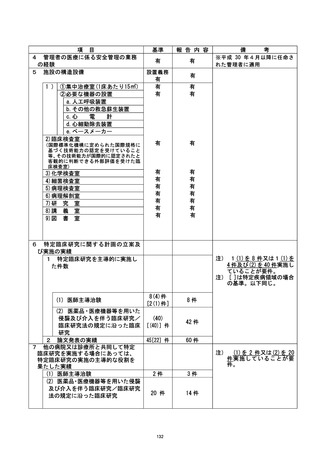
| 不適正事案に関する対応状況 :
2022年1月19日の個別試験監査実施後、2022年2月18日に当院研究責任医師である研究
代表医師からCRBへ「重大な不適合報告 (2022年2月3日および2022年2月10日) 」が提
出され、2022年2月28日に承認 (通知日 : 2022年3月2日、 意見なし) された。
同日、当院管理者へ重大な不適合報告が行われ、2022年3月11日の臨床研究監理センタ
一運営委員会にて下記事項を付記のうえ承認、3月17日の臨床研究委員会運営会議にて
報告、了承された。
【付記事項】
有害事象のために投与中止となった 1 例については、 毒性評価に加え、考察を総括報告
書に記載すること。
= ーーーーーー
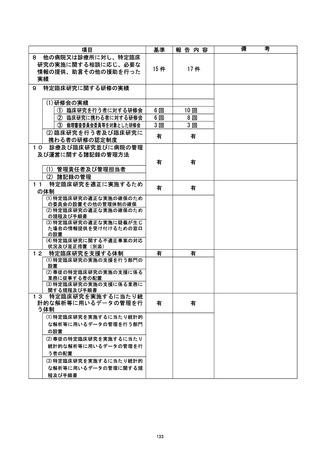
是正措置 :
(1) 研究責任医師による対応
登録された3症例ごとに試験登録期間が終了した時点で、研究班内でミーティングを行
い、有害事象の有無やプロトコールの確認を徹底し、再発を防止する。
(2) 当院管理者による対応
臨床研究監理センター運営委員会および了欧床研究委員会運営会議において、有害事象の
ために投与中止となった 1 例について、遼性評価に加え、考察を総括報告書に記載する
ことに関する注意喚起を行った。
存 9
登録等 | に還国還還議 治験・條床研究名
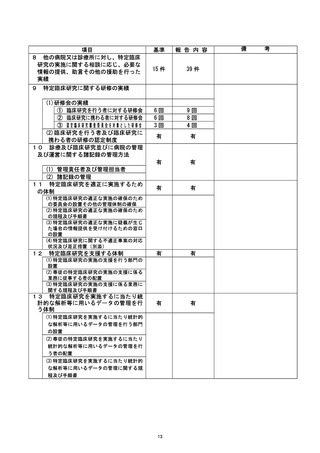
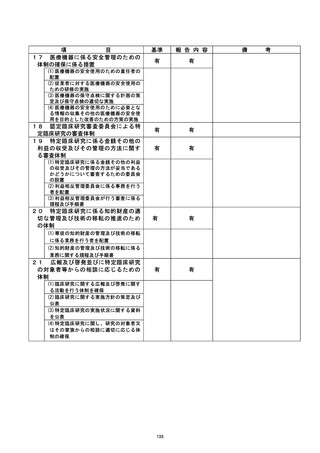
不適正事案の概要 :
当院では未許可の説明文書・ 同意書で同意を取得した。 (1]例)
2020年8月4日、他機関主導の特定臨床研究で、説明文書・同意書改訂の変更申請が他機
関 CRB で承認された後、当院で継続実施許可を得ずに使用され、研究対象者1名の同意
が取得された。
(多機関共同研究[他機関主導] 、他機関 CRB)
不適正事案に関する対応状況 :
当該特定臨床研究を対象に当院が実施した法・倫理指針適合性監査の監査報告書 (202
1年12月17日付) において、所見として指摘され、了臨床研究監理センターによる確認の
結果、説明文書は当院で実施許可を得た「第2.22版」であったが、同意書は未許可の
「第2.3版」 であった。
研究責任医師から、発生要因として、説明文書・同意書改訂後の当院における継続実
施許可の申請漏れが報告され、当該研究対象者より再同意を取得する対応方針が提出
された。
3 月 11 日の臨床研究監理センター運営委員会にて報告、承認された。
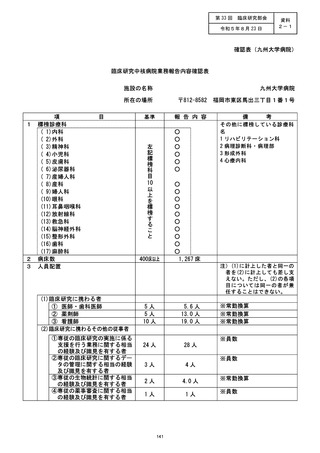
是正措置 :
( 1 ) 当院研究責任医師による対応
2022年3月30日に、当院研究責任医師から当院管理者へ「重大な不適合報告 (2022年3月
58