資料2:臨床研究中核病院業務報告内容確認表 (57 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
しかし当該研究対象者は、前医における病状の変化などから、 予定されていた本研究へ
の登録時期が11月から12月に遅延し、これに伴って一部の登録前検査の結果が研究計画
書に規定された期間外となったのに対し、研究責任医師は当該検査の再実施を失念し
た。
研究責任医師は、当該検査がベースライン検査として研究計画書に規定されていること
を踏まえ、本件を重大不適合と判断した。
(多機関共同研究[自機関主導]、自機関 CRB)
不適正事案に関する対応状況 :
本件不適合の判明後、研究責任医師はモニタリング実施を指示し、その結果を踏まえ
、2022年2月4日に当院研究責任医師である研究代表医師からCRBへ「重大な不適合報告
(2022年2月4日) 」が提出された。
同 年2月28日のCRBにて当該報告は審議され、その結果、一部の加筆修正等の指示によ
り 継続審査 (通知日 : 2022年3月2日) となった。なおCRBへの上記報告と同日に、当院
管理者へも重大な不適合報告が提出され、3月11日の臨床研究監理センター運営委員会
にて承認、3月17日の臨床研究委員会運営会議にて報告、了承された。
4月11日、研究責任医師よりCRBの意見に従い一部修正した「重大な不適合報告 (2022
年4月11日) 」が提出され、4月15日に簡便な審査により承認 (2022年4月15日) された
同日、当院官理者へ当該報告書が提出され、5 月 6 日の臨床研究監理センター運営委員
会にて承認、5 月 19 日の臨床研究委員会運営会議にて報告、了承された。
是正措置 :
(1) 研究責任医師による対応
複数の併存症・既往症を抱え、かつ個人的な都合から通院調整が困難な研究対象者の適
格性確認手順の認識が不十分であったため、適格性確認プロセスの改善が必要であると
判断し、適格性確認のためのチェックリストを作成し、運用するとともに、そのプロセ
ス実施をチェックするCRC の導入を検討する。
共8
を名1D生| 還還還還還
|
不適正事案の概要 :
2017年12月に第 1 相から第Tエ相へ移行する際、評価対象とする条件を満たさない症例を
含めて移行を判定した。
本研究は、第 1 相部分で「研究薬を8回投与された6症例」 を対象に安全性を評価し、第
II 相への移行可否を検討する研究計画であったが、研究薬投与が8回未満の症例を含む
「登録順の第1一第6症例」 で評価し、 移行可能と判断して、 第7症例から第IL相部分に移
行していた。
2022年1月に実施された個別試験監査で、所見として指摘があり、発覚した。
研究薬投与が8回未満であった症例は3例で、うち2例は原疾患悪化により中止、1例は有
害事象 (発熱唱吐) により投与を中止していた。
2022年2月、 本来の研究計画に則った「研究楽を8回投与された6症例」 により、 改めて第
I 相移行の適生が再評価され、その結果、移行中止基準に該当する毒性は認められず、
第 H 相への移行は適切であったことを確認した。
発生要因として、当該診療科では、本試験の他に当該試験薬を使用した了攻床試験が3試験
実施されており、他試験では評価対象を「研究薬が8回投与された症例」 に限定する規定
がなく、評価対象症例を誤認したことが報告された。
研究代表医師より、 再発防止策と して、登録された3症例ごとに試験登録期間が終了した
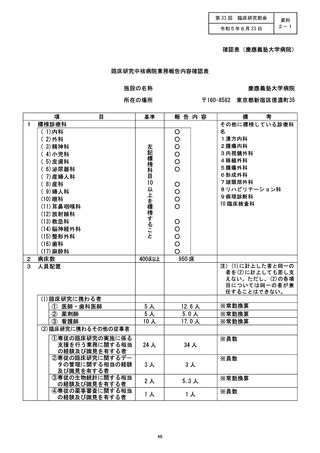
治験・臨床研究名
57