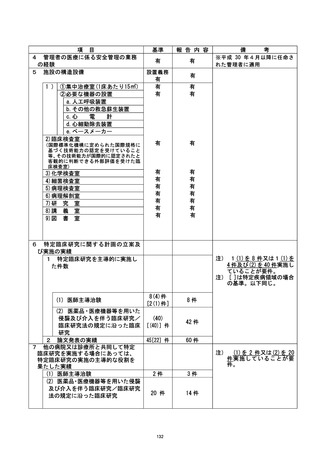
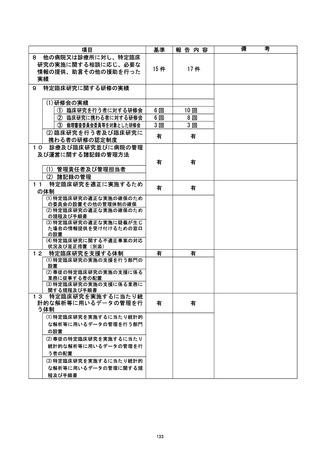
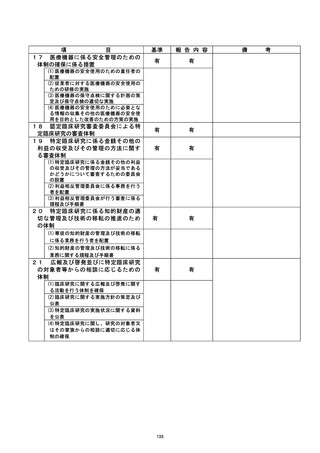
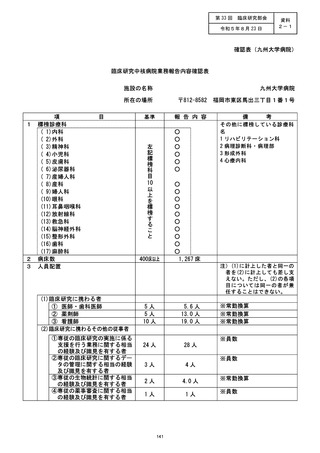
資料2:臨床研究中核病院業務報告内容確認表 (127 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
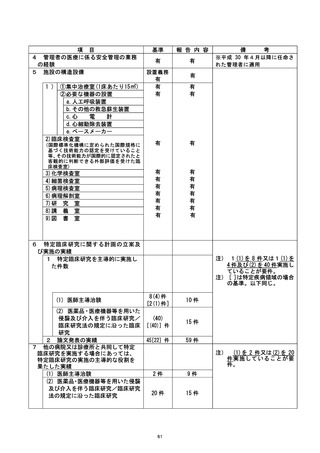
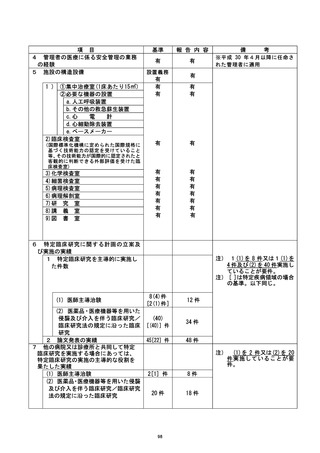
管理委員会では当該重大な不適合を審議し、当該診療科に対する対応方針を検討し、
以下を指示することとした (2021年7月16日付) 。
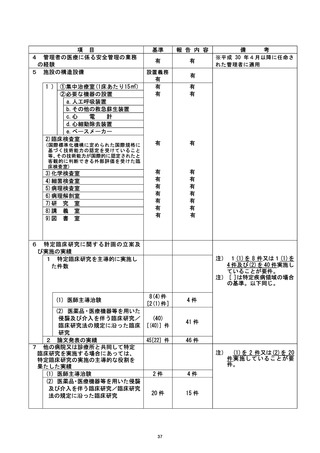
① 当該臨床研究の停止。
② 当該診療科で実施中の特定臨床研究及び介入研究に係る新規症例登録の停止。
③ 当該診療科で実施中の特定臨床研究及び介入研究に係る調査の実施。
④ 半数以上を外部者で組織する外部調査要員会 (以下、調査委員会) を組織して
査を行う。
⑤ 教育 (e-learning受講) の受講ならびに臨床研究推進セミナーの受講。
⑤⑥ 該当患者に当該研究が停止となったことを説明する。
強
上記④の調査要員会を開催 (2021年8月17日、9月30日) し、関係者に対してヒアリン
グを行った (2021年9月8日) 。調査和要員会において、当該研究の研究責任医師から提
出のあった適格性に係る調査結果及び再発防止に向けた改善策などを確認した (2021
年11月17日) 。
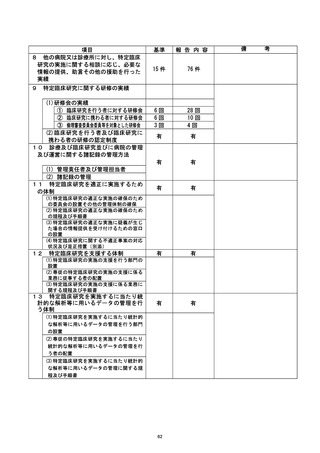
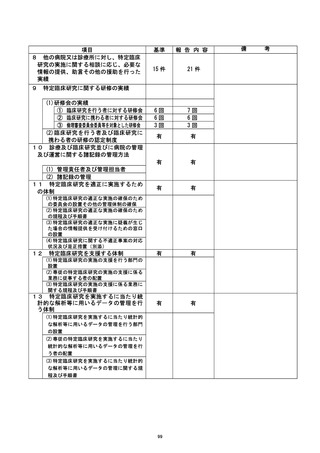
調査委員会からの提言
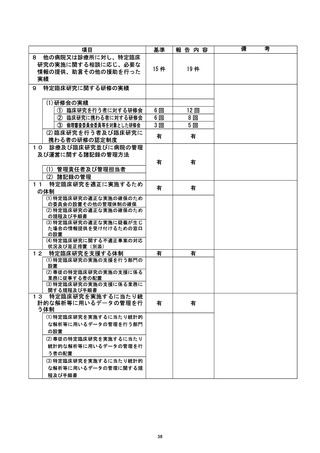
① 特定臨床研究への意識を高める対策が必要である。 教育体制を構築し、セミナー
等を通じて、繰り返し教育を行うことが大切である。
② 臨床研究中核病院として、臨床研究に対する医師への支援体制を更に充実させる
必要がある。
| ③ 入力エラーやデータの不整合について、システム的にチェックできるようにEDCを
構築することが望ましい。
④ 臨床研究の計画段階において、研究として不要な項目の精査を行う等、準備段階
を充実させる必要がある。
2021年11月19日の管理委員会において、本事案の対応に関する調査報告書を取りまと
め、研究代表者に当該研究の中止を求めることとした。
2022 年 2 月 18 日に研究代表医師から重大な不適合報告書 (最終報告) が CRB に提出さ
れ、3月3日のCRBで中止する意向である旨も含め審議され、承認された。
|
この事案は、2021 年 11 月 29 日及び2022 年3月 17 日開催の特定覧床研究監査要員会へ
報告された。 |
是正措置 : |
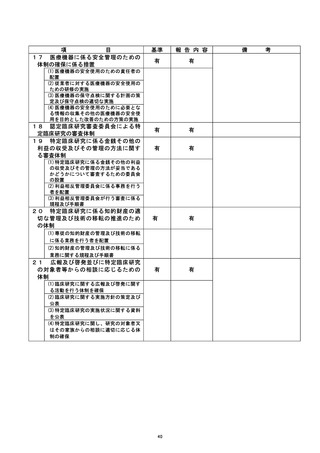
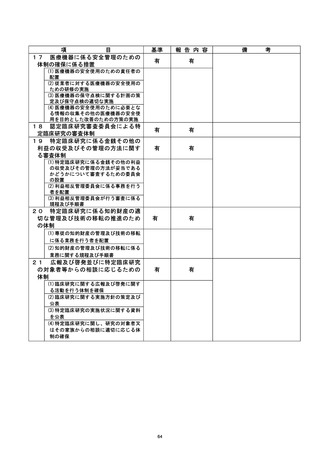
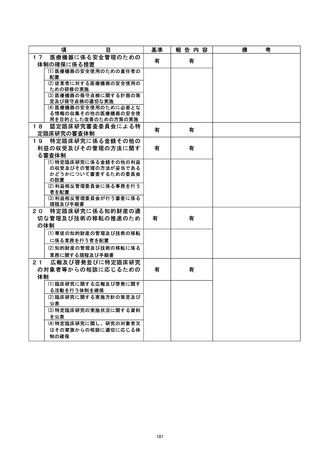
【当該研究グループとしての再発防止策について】
臨床研究管理委員会および特定臨床研究監査委員会において、当該不適合事案のあっ
た当該研究グループに対して、以下の再発防止策を講じた。
① 臨床研究にかかわるe-learningを臨床研究に携わる研究グループ全員が受講し、
臨床研究に対する知識や同意取得に対する認識を徹底する。
② 現在行っている介入研究全てについて、あらためて泌尿器科腫瘍グループ全体で
プロトコルの内容を確認する。
③ 全ての臨床研究法下の臨床研究および倫理指針下の介入研究を対象として、新た
に登録する全ての症例について、当分の間、症例登録票および同意書を臨床研究
推進センターへ送付し、臨床研究管理委員会へ報告する。
④ 半年に一度のモニタリング以外に、全ての攻床研究法下の臨床研究および倫理指
針下の介入研究時に取得した同意書について、同意取得した医師以外の者 (責任
医師) が、別紙チェックシートを用い、同意取得プロセスの適切性を1週間以内に
確認する。
127