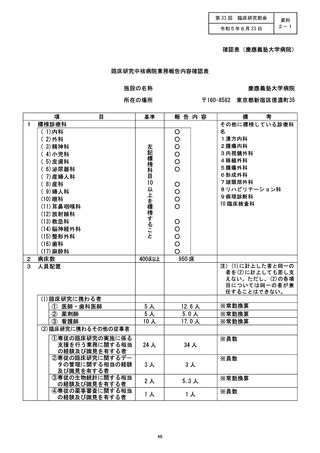
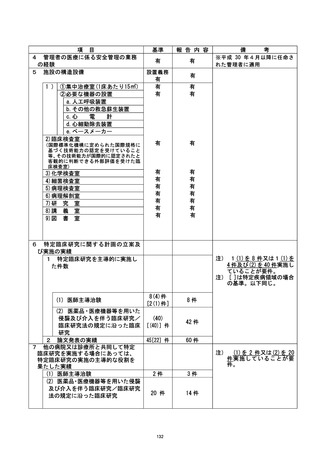
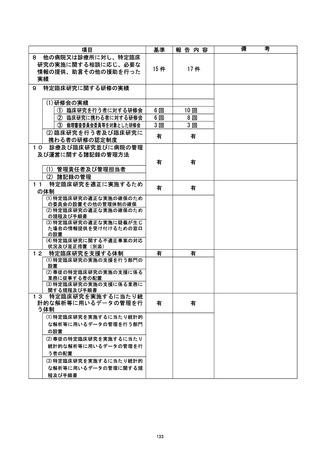
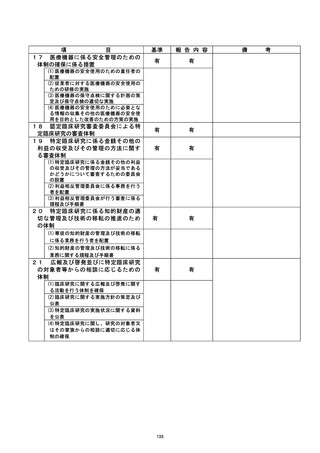
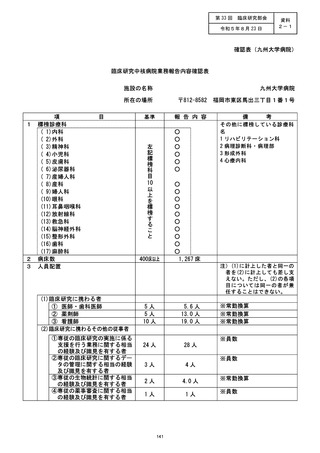
資料2:臨床研究中核病院業務報告内容確認表 (139 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
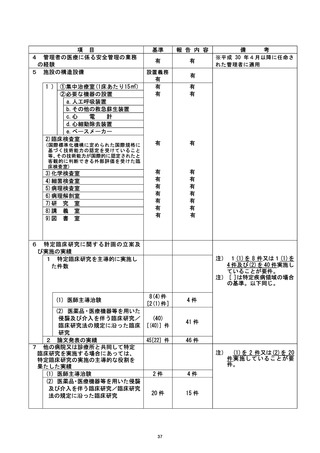
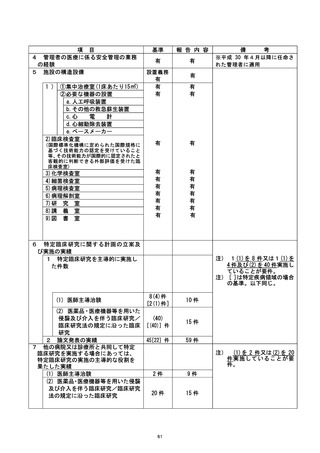
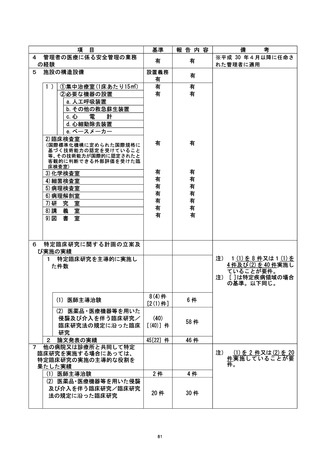
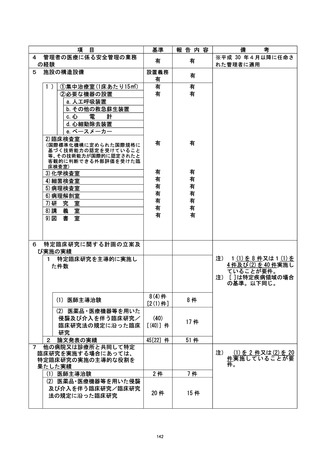
| 行い、 不適合報告書を提出 した。 また、 不適合発生直後に、 研究対象者の健康状況を確認
| し、 安全性に問題がないことを確認した。 次に研究対象者に不適合発生について説明・謝
罪し、 研究の継続 (2 日後からの被験薬の投与再開) について同意を得て、同対象者に対
| して研究を継続させていただくこととした。
| 是正措置 :
本事案が発生した原因として、(1) 研究責任医師は、事前に移植日等が変更になる場合
は、 被験薬開始日も変更する必要になるため留意するよう連絡していたが、分担医師に十
分に伝わっていなかった可能性、(2) 研究分担医師が本研究の計画書の内容について十
分に理解できていなかったか、急遼予定を変更せざる得ない状況となったため、 研究計画
書の内容を再確認する余裕がなかった可能性、が考えられた。 不適合発生当日中 (2022 年
4月6日) に、 臨床研究を実施する診療科の医師、病棟着護師、病棟薬剤師、輸血部上員の
全員へ本事案について連絡し、移植日程変更の際の情報伝達方法について再確認を行っ
た。 さらに、 変更があった場合には、 至急の連絡を研究責任医師または研究事務局に行う
ことを各関連部署に通達した。 また、本事案発生までの経緯について詳細な聞き取り調
査を行い、 移植に必要な細胞数が不十分であることが直前に判明し、 移植日を急遼変更せ
ざるを得なかったという稀なケースではあったが、担当医から各部署への連絡が不十分
であったことが反省点として挙げられた。 そのため、以下の点について、以後注意する
ことが確認された。
① 決定後の移植日程のいかなる変更に関しても、日をまたがない速さで関係部署へ通達
する。
② 予定日変更の可能性がある研究対象者については、予めのその旨を研究責任医師へ連
絡する。
③ 研究に参加中であることを、カンファレンスにおいて関係者間で確認する。
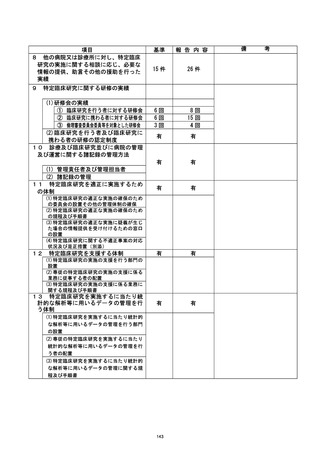
なお、 本研究における被験薬[ であり、本研究においては適応外使用であるも
のの、 通常は の効能・効果で市販されているものであり、その安全性は
確立している。 今回の不適合による健康被害は考えにくく、安全性については問題がない
と考えられるが、引き続き慎重に健康状況の確認を行っていく予定。
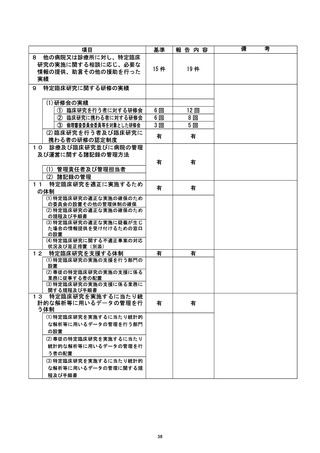
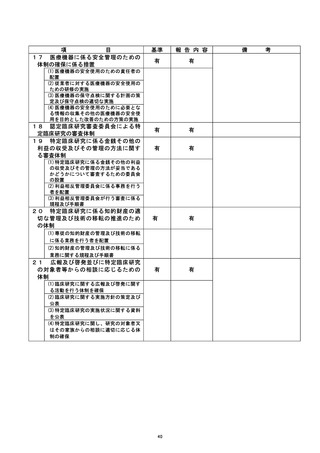
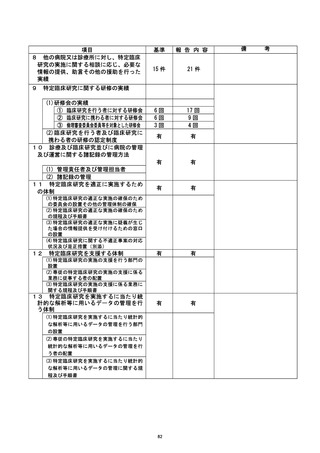
| 治験・臨床研究名 |
不適正事案の概要 :
@多施設共生条次 (問還還還還還主管)
@不適正事案発生施設 : 岡山大学病院
不適正事案の内容 :
計画書では同意取得後のデータを使用して適格性判断と登録を行う規定となっていた
が、 同意取得前のデータ を使用して適格性判断と登録が行われたため、不適合と判断され
報告が行われた。
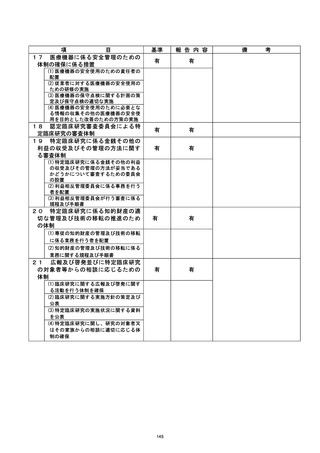
不適正事広に関する対応状況 :
2022 年 3 月 19 日、研究対象者より同意を取得し、3 月 15 日に実施されていた血液検
査の結果を使用して適格性を判断した後、 EDC にて登録を行った。 4 月 20 日、 主管の較議
訣請還畔の 2 「適格性確認のための血液検査入力日」に関する問合せがあり、4 月 26 日
139