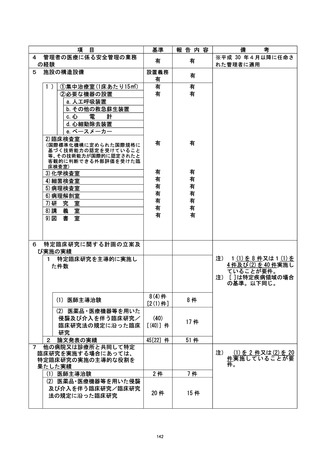
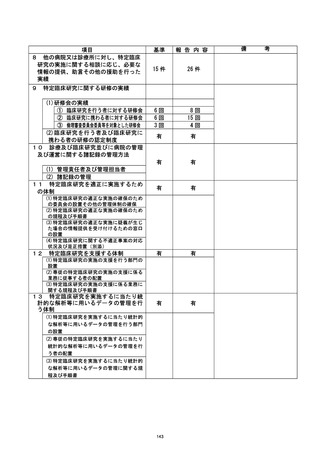
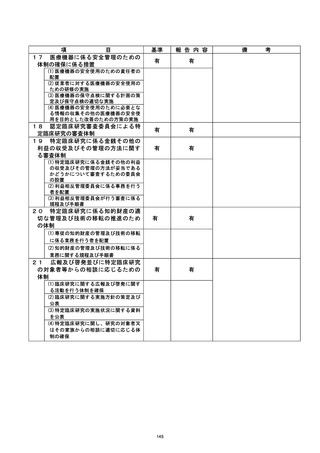
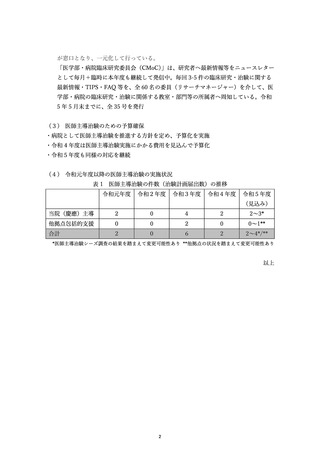
資料2:臨床研究中核病院業務報告内容確認表 (124 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
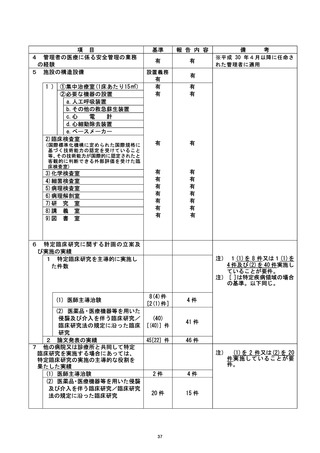
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
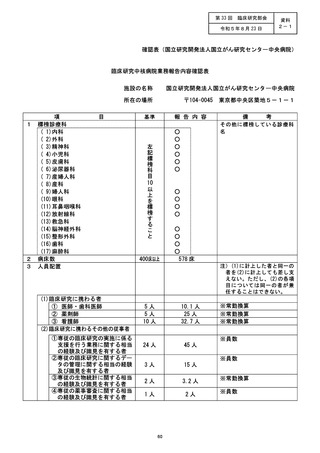
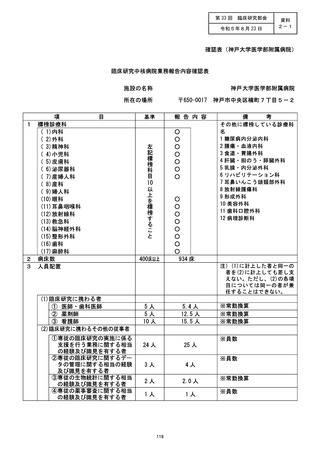
施設の名称 (神戸大学医学部附属病院)
治験・臨床研究名
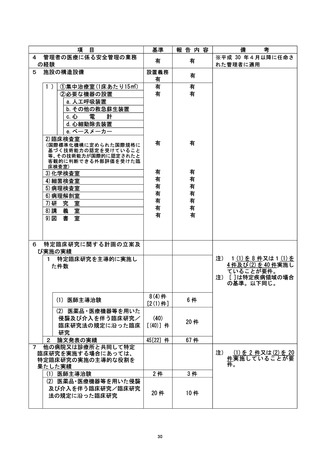
不適正事案の概要 : |
「適格性を満たしていない症例の登録」
2021年2月12日、他科から当科に対象者識別番号Bic-64の患者のビロリ菌除菌依頼があ
った。 併用禁止薬であるPPIが紹介元で処方されていたが、共床上必要がないと考え、
紹介元の処方医に臨床上の必要性について確認した。処方元でも継続の必要性は臨床
上なく、患者も内服しないことに同意されたため、PPIの内服中止を決定した。同日、
本臨床研究の同意を取得し、除外基準(2)の「除菌治療開始の4 週間以内に抗菌薬、ま
たはPPI の服用がある患者」には当てはまらないことを確認のうえ、研究登録を行っ
た。しかし、その後も、患者は手持ちのPPIを誤って内服し、研究開始 4 週間前の時点
および、研究期間中も内服していたことが、5月14日の研究終了時に判明した。 今回、
臨床上必要である治療ではなく愚者が誤って内服をしたため、皿急回避のための治療
には該当せず、重大な不適合に該当すると判断した。
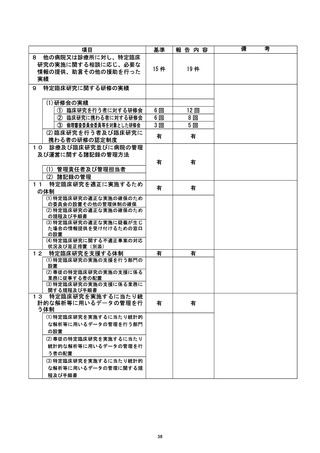
不適正事案に関する対応状況 :
2021年5月24日、研究責任医師から重大な不適合報告書が認定臨床研究審査委員会に提
出された。2021年6月7日の認定臨床研究審査上員会で審議され、承認された。また、2
021年5月27日の臨床研究管理委員会 (以下、管理委員会) に報告された。
被験者に対して、PPIが内服継続となった経緯を確認し、同意取得者から受けたPPI中
止の説明に関して理解できていたか確認したところ理解はできていた(手持ちのPPIが
あったため内服してしまった) 。 健康被害がなかったことも確認した。
臨床研究マネジャー会議で共有し、注意喚起した。
是正措置 :
是正措置として、際菌治療開始時点や研究期間中に併用禁止薬が処方された場合は、
患者に必ず緊急連絡先に申告してもらうように研究開始前の説明を強化することとし
上た 。
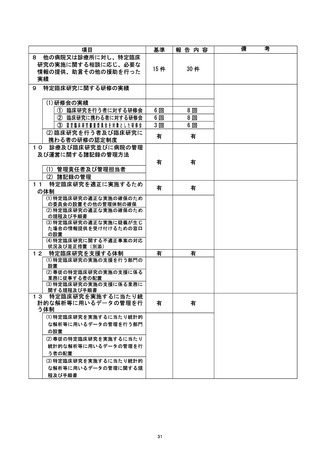
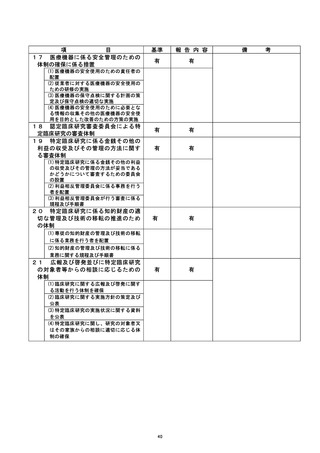
登録 ID 等 9
不適正事案の概要 :
①「同意取得日、適格性確認日、試験薬投与開始日の順序の不整合があった症例の登
| 録 (同意取得の遅れを除く) 」 : 19件
試験開始前に同意は取得し、適格性の確認を行った上で試験を開始しておりますが、E
DC上にて行うべき登録作業が遅延したためにプロトコール違反となり、不適合となっ
| た
124