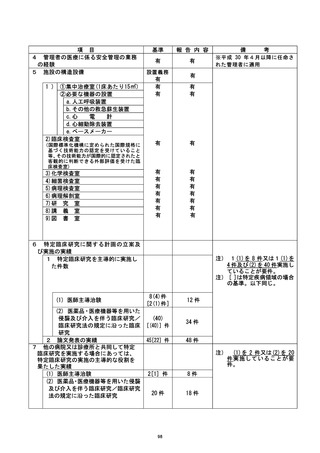
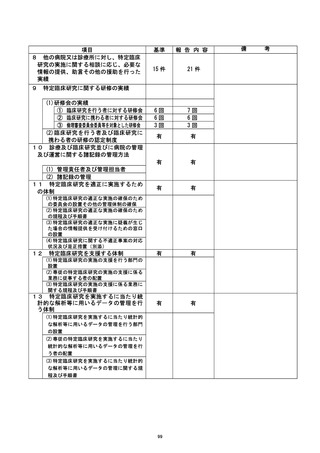
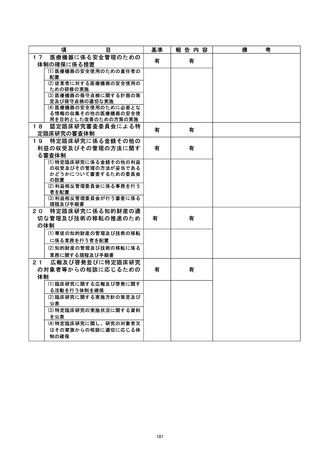
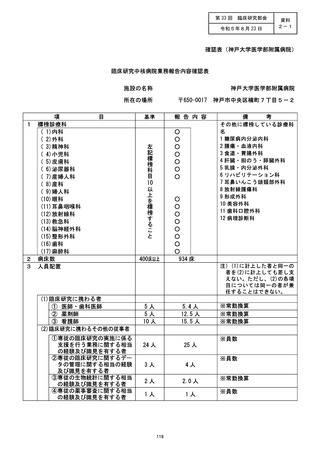
資料2:臨床研究中核病院業務報告内容確認表 (125 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
②「同意取得日が試験開始よりも遅れた症例の登録」 : 1件
口頭同意の取得のみにて試験薬の投与を開始し、投与開始後に文書同意を取得した案
件となる。この案件につきましては、和被験者には口頭にて同意を事前に取得している
ことから、プロトコール違反ではあるものの、被験者の安全性に対する影響はないと
研究者は判断した。
③「適格性を満たしていない症例の登録 (登録前臨床検査値) 」 : 5件
適格性基準からの逸脱ではあるものの、ニボルマブの人上床使用では、貧血や高ビリル
ビン血症に対する制限は規定されておらず、被験者の安全性に対して大きな影響はな
いと研究者は判断した。
④「ベースライン画像診断の許容範囲を超過した被験者への試験治療の実施」 : {1件
プロトコールではベースライン画像は投与28日以内と規定されているため、プロトコ
ール違反となります。この案件は、薬効評価の観点から設定された基準であることか
ら、被験者の安全性に影響はないと研究者は判断した。
⑤「試験開始前の病理報告書および試験開始以後の画像検査の未実施があった被験者
への試験治療の実施」 : 1件
紹介元施設で投与後フォオローされており、紹介元施設からの経過報告書、開始前病理
伝票および画像報告書のコピーを入手しております。
この案件は、薬効評価の観点から設定された基準であることから、被験者の安全性に
影維はないと研究者は判断した。
⑥「計画書改訂前に試験治療の投与量が変更された被験者の実施」 : 3件
本試験で使用されたニボルマブは試験開始後に3mg/kgから240mg/bodyへの深付文書上
の改定がなされており、これに従って変更を行いましたが、本試験におけるプロトコ
ールの改訂承認前に投与量を変更したことによるプロトコール違反であり、被験者へ
の影響はないと研究者は判断した。
⑦「適格性を満たしていない症例の登録 (病理) 」 : 2件
本試験で使用されたニボルマブは、転移性腎細胞癌を対象に保険収載されており、病
理学上の詳細な規定はなされておらず、非淡明細胞癌での使用は認められております
。したがって、被験者の安全性に影響はありませんが、病理学的に淡明細胞癌と確定
された症例を対象とした本試験においてプロトコール違反となる。
⑧「重大な疾病等の報告遅延」 : 1件
疾病等に対しては適切に対応を行っており、被験者への影響はありませんでした。ま
た、報告遅延が判明した後、重大な疾病等の報告を直ちに提出しております。
なお、今回の重篤な疾病等報告は、被験薬と既知の有天事象であることから、報告の
遅延によって本試験の安全性に大きな影響を与えるものではないと研究者は判断した
記
⑨「適格性を満たしていない症例の登録 (重複部) 」 : 1件
経過中に発症した白血病と既存の腎癌に対する併用治療を腫瘍血液内科と相談したう
えで、ニボルマブと白血病治療楽を併用しておりました。したがって、被験者の安全
性に影響はありませんが、重複癌を除外基準に挙げている本試験においてプロトコー
ル違反となる。
同意取得日 : 2020/1/21
125