資料2:臨床研究中核病院業務報告内容確認表 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
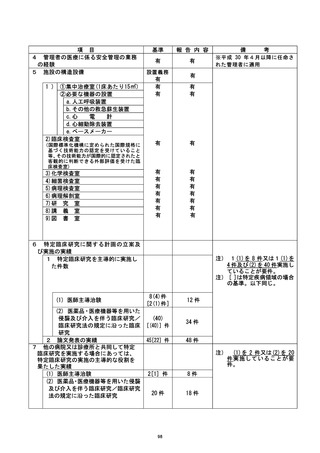
本学利益相反アドバイザリー室の確認を受けることを規定しているが、その手順が行わ
れていなかった。
不適正事案に関する対応状況 :
当院管理者の実施許可の前に当該不適合が判明したため、臨床研究の対象者の人権や
安全性及び研究の進捗や結果の信頼性に影響を及ぼすものではないと考える。
令和 4 年 3 月 8 日付で実施計画変更手続きを行い、令和 4 年 3 月 24 日付で半請請主議
査委員会に承認された。 不適合報告を当院管理者及び研
究代表医師 ( ) 宛 (令和4年2月7日) に行った。特定臨床
研究運営委員会 (令和 4 年 3 月 29 日) に報告した。
是正措置 :
利益相反申告の手続きにおける手順を十分理解していなかったため発生したと考える
。了臨床研究法上必要な院内の手続き等を再度確認し、研究責任医師および研究分担医
師 (ダブルチェック) で手続き方法の十分な確認を行う。
また、 臨床研究指導員研修会 (令和 4 年 10 月 3 日開催予定) |において、 利益相反管理計
画の作成、確認徹底について、了臨床研究指導員を通じて院内の全診療科に周知する予定
である。
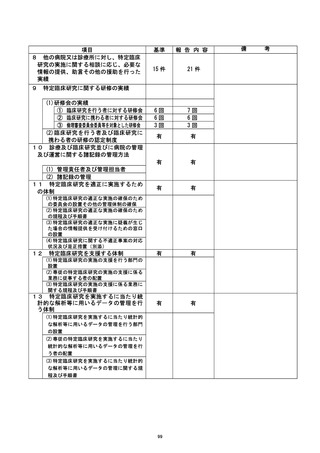
登録 D 等 還還還還還 治験・臨床研究名
不適正事率の概要 :
事前授与1コース投与開始日が規定の範囲外であった。
事前投与1 コースの投与開始日 (信和3年9 月16 日) は、研究計画書規
定の 台
治療終了日 (令和3年8月 26 日) から 22<56 日後ではなく、21 日後であ
り、規定より 1日ずれていたことが、令和3年11 月 24 日のモニタリングで判明した。
不適正事案に関する対応状況 :
不適合の内容としては軽微な逸脱であり、研究対象者への影響はないため「重大な不
適合」に該当しないと考える。
試験実施計画書からの逸脱報告書を研究代表医t に還語還語)
に対し提出 (令和3年12月2日) し、不適合報告を当院管理者及び研究代表医師宛 (令
和4年2月8日) に行った。
特定臨床研究運営委員会 (令和 4 年 3 月 29 日) に報告した。
是正措置 : -
呈還較:療終了日 (令和3年8月26日) が当初想定していたスケジュールより1日ずれて
いたことが原因である。再度、研究計画書に規定されている許容範囲を確認して、許
容範囲内で投与開始するよう、研究分担医師を含めて研究に従事する者に周知する。
臨床研究指導員研修会 (令和4 年10 月 3 日開催予定) において、プロトコールに規定
されている許容範囲を含む記載事項の確認徹底について、攻床研究指導員を通じて院内
の全診療科に周知する予定である。
35