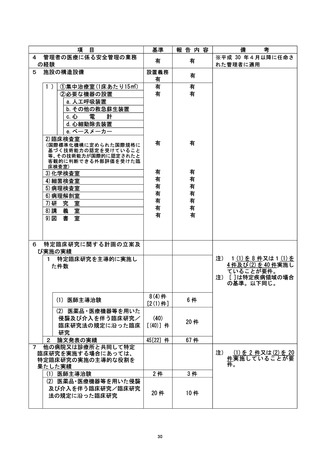
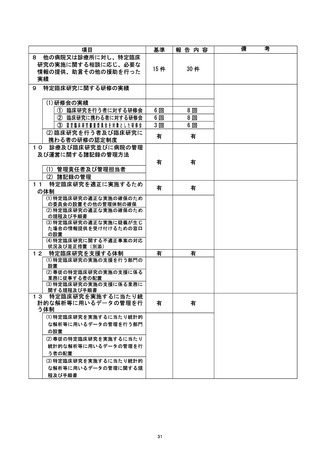
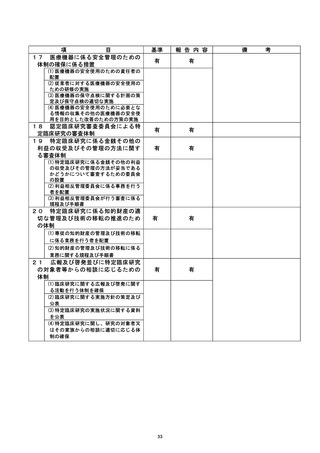
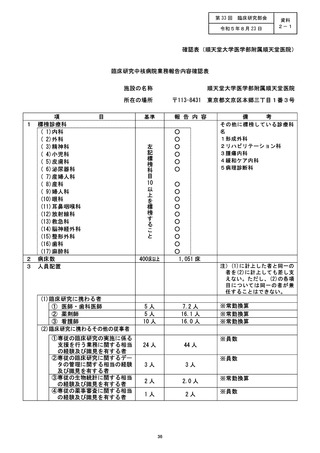
資料2:臨床研究中核病院業務報告内容確認表 (104 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
当院においても同意説明文書の改訂および拉験者への説明を実施した。
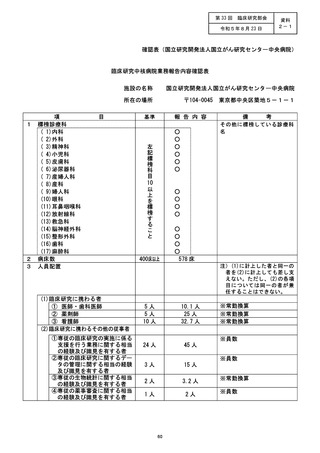
登録等 | 請較 治験名
担当モニターより指摘があり注目すべき有害事象報告の遅延が判明した。
不適正事案の概要 : 注目すべき有害事象の報告遅延
治験では、† 細胞性リンバ芽球性リンパ腫/T 細胞性急性リンパ性白血病又は骨髄異形
成症候群を含む骨髄系腫瘍を注目すべき有害事象とし、1 労働日以内に治験依頼者に報
告するという規定がある。2021 年 9 月 30 日、CRC が電話にて依頼者に被験者の状況報
告をしている際に、骨庄異形成症候群 (2021 年 9 月 24 日診断) が報告対象である旨、
不適正事案に関する対応状況 : |
CRC が責任医師へ報告し「注目すべき有害事象」として依頼者に報告した。また、被験
者に病状について説明、現時点で治療介入の必要はなく経過観察および治験継続と判断
し、本事案による被験者への安全性の問題はないと考える。今回、プロトコールにより
本事案が報告対象疾患に該当したため、重大な逸脱として直ちに依頼者に報告した。 |
是正措置 :
SAF とともに、 注目すべき有害事象に関しても内容を再度把握し、 関係部署に周知する。
同意取得後、治験参加中の方に作成する電子カルテ上の付箋上に (併用禁止薬・入院時 |
の連絡先などを記載しているもの) 、注目すべき有害事象に関しても明記することにし
た。他科や病棟主治医でも把握できるようにする。
登録1等 | 較請詞 治験名
不適正事案の概要 :
2020/12/7 治験実施計画書に定められた規定 Visit において、EGCOG PS、心電図異常の
有無の評価及び治験薬投与可否の判断を治験責任・分担医師ではない医師が実施してい
た。院内内部調査により 2021/11/5 に発覚した。
治験担当医師・CRC ともにこの日に対応を依頼した医師が治験分担医師であると思い込
み、治験分担医師リストを確認する手順を失念した。 還還 |
不適正事案に関する対応状況 : _- |
速やかに治験依頼者に報告した。
是正措置 : |
同意取得時以外でも普段と異なる医師に治験業務を依頼するときは分担医師と CRC とで
依頼する医師が治験分担医師であることを確認する手順を徹底する。 |
登録等 | 還軒畔 治験名
不適正事案の概要 : 治験用機器ではなく市販用機器を使用
104