資料2:臨床研究中核病院業務報告内容確認表 (75 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
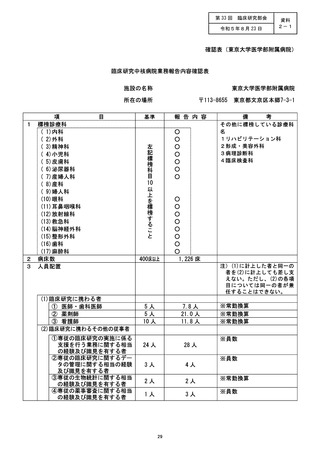
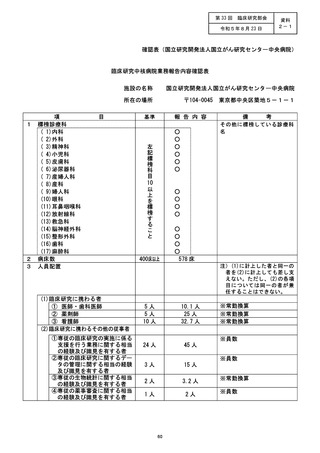
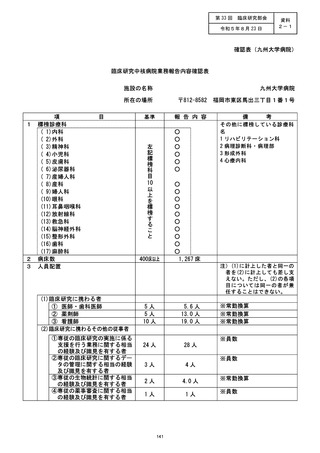
施設の名称 (千葉大学医学部附属病院)
不適正事案の概要 : ]
治験業 GMP 業務の重大な逸脱による医師主導治験の中止
治験薬に関し、本来であれば設定根拠にできない原薬の使用期限情報をもとに使用期
限を設定し、さらに治験開始前に治験ロットとは異なる製剤ロットでの長期安定性試験
を実施せず、治験ロットのみで長期安定性試験を実施していた。 治験開始時に治験薬の
使用期限を設定できていなかったことが確認された。再納入を予定していた製剤も事前
に安定性の確認がされていないため、使用期限が設定できないことから、治験薬として
適切でないとの結論に至った。
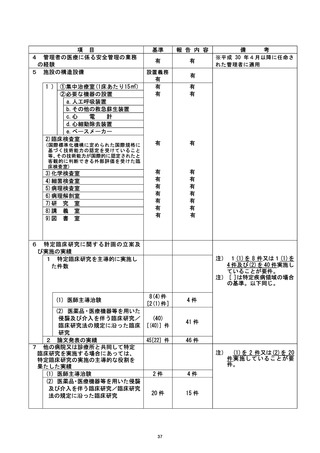
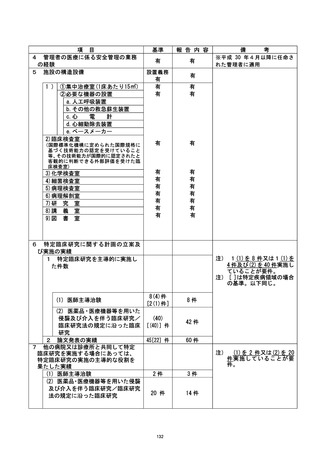
特定臨床研究に関する不適正事案
登録 ID 等 | に還還還還較
不適正事案に関する対応状況 :
2019 年7 月に納品された製剤を用いて、 すでに 3 症例の投与がなされていたが (投与
期間 : 2020 年5月-7 月) 、2020 年 9 月に実施された品質試験の結果、すべての項目で
適合であることが確認され、投与期間における本製剤の品質は適切に保たれていること
を確認した。
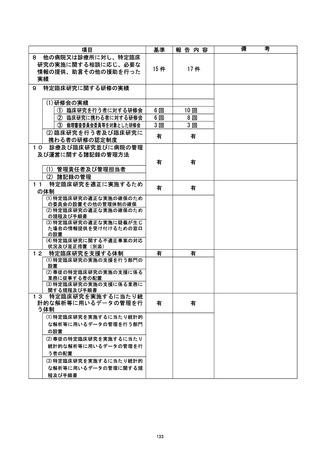
自ら治験を行う者は、治験薬提供企業から次の治験薬を納入できる時期を明確にする
ことが出来ない状況であるとの陳述を受け、2021 年 10 月 25 日に当該治験を中止するこ
とを実施医療機関の長へ報告した。治験客査要員会は、2021 年 11 月 15 日に審議の結
果、既承認事項の取り消し (開発中止) を決定した。また、本件の対応については同年
11 月 22 日の臨床研究基盤整備推進・管理委員会にて、審議の結果、承認された。
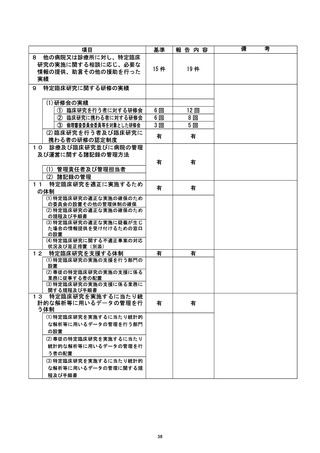
是正措置 :
自ら治験を行う者は、今回の事象は治験薬 GMP 上極めて重大な人逸脱に相当すると認i
しており、PMDA へ速やかな報告を行った。 治験薬製造体制の再整備の後、改めてその体
制整備の完了の検証が必要との判断に至り、現時点で次の治験薬を納入できる時期を明
確にすることができない状態であることから、自ら治験を行う者は本治験を中止した。
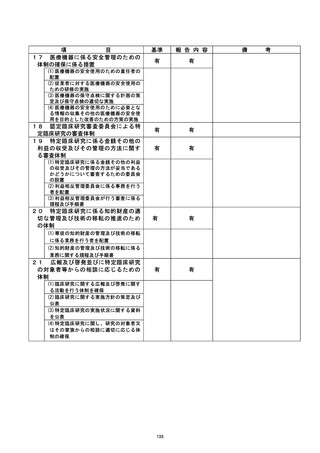
登録 [DD 等 還国滞滞語 治験・臨床研究名
不適正事案の概要 :
除外基準に抵触する患者の登録
研究終了後、「除外基準(⑫②) 研究登録前 4 週間以内に併用制限薬の用法・用量を変更
した患者」に抵人していたことが判明した。
75