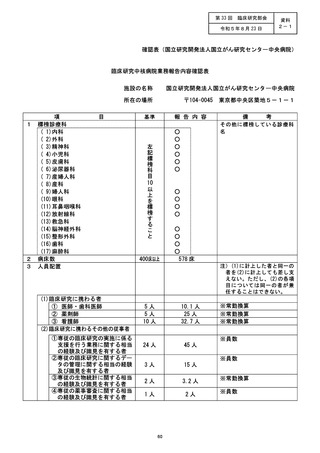
資料2:臨床研究中核病院業務報告内容確認表 (106 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ことが後任 CRC への業務の引継ぎの過程で、2021 年 12 月 6 日に判明した。
別添
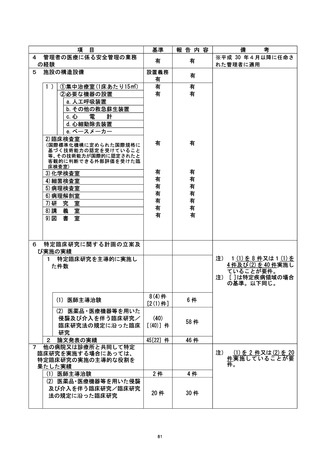
不適正事案に関する対応状況 :
12月15日 上記について当院の臨床研究総括委員会で才議した。 1月11日 IRB は、
実施診療科の診療科長により、本治験における安全性、有効性について確認の上報告を
あげるよう指示した。
2月 8日 IRBは実施診療科長からの報告に 基づき治 評価に影響よしないことを確認
し、治験継続を承認した。なお、12月21日に治験協力者を追加し、バイタルサイン測定
日のプロセスを晃直し、 体制を整えた。これらを治験依頼者に3月9日に報告した。
3月24日 治験依頼者によるグローバル監査では、ALCOAの不遵守の指摘があり、指摘事
項に 対し是正措置 、予防措置を講じている。
是正措置: 2022 年 4 月 責任医師を交代し、 担当医師、治験協力者は、 ヲ下ヨラリルの1
再確認を行い、プロセスの見直しを行った。なお、同年 2 月に各診療科代表の臨床研究
マネジャーが集まる臨床研究マネジメント委員会、及び全研究者を対象とする臨床研究 |
講習会において、不適切事案としてフィードバックしている。また同年 { 月より、新規
治験のスタートアップ時に担当教員により、原資料に関する説明を治験責任・分担医師
向けに行っている。
登録等 | 請請譲 治験名 |
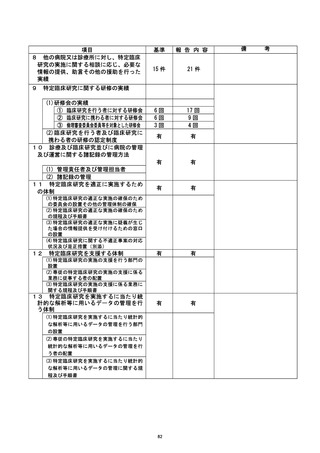
不適正事案の概要 : ICF 本体に付随する ICF 補遺 (第 1 版) の口頭同意および ICF 補遺
の改定版 (第2版) の口頭同意・ 文書同意取得遅延
本治験では、ICF 本体を改定せずに新たに 【ICF 補遺 (第 1 版) を作成し、さらに ICF 補
遺の改定 (第2 版) を行った。
2021/9/17 1ICF 補遺第 2 版を作成。2021/10/26 ICF 補章第 2 版が IRB にて審議され、
承認。
2021/11/19 CRC が !ICF 補遺第 2 版の製本版を受領。2021/11/22 CRCが11 月30日IRB
審議予定の実施計画書等変更申請リストを確認したところ、甲請の記載が無く、10 月
IRB での審議、承認されていたことが判明した。本来であれば 4 例に対して口頭同意・
文書同意が必要であったが、審議された IRB 直後の各被験者規定来院は、すでに実施済
みであったことから、 文書同意未取得が判明した。また、担当CRC は IF 補遺第 2 版に
ついて口頭同意は不要であると担当CRA より見解を得ていたため、口頭同意も未実施で
あった。 同様に ICF 補遺第 1 版についても担当CRA より口頭同意不要との見解を得てい
たため、 文書同意は取得していたが、7 月 21 日被験者来院時に口頭同意を取得する必要
があったことが判明した。
いて説明し謝罪を行った。
不適正事案に関する対応状況 :
介脱発覚後、各被験者の主治医 (分担医師) は電話にて ICF 補遺第 2 版について情報提
供し、謝罪と治験継続の確認を行い、次回来院時に文書同意取得を行った。
また、 補遺第 1 版該当被験者に対して iCF 補遺第 1 版の口頭による情報提供の遅延につ
是正措置 :
・PI より口頭同意の重要性について CRC へ再教育行う
106