資料2:臨床研究中核病院業務報告内容確認表 (112 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
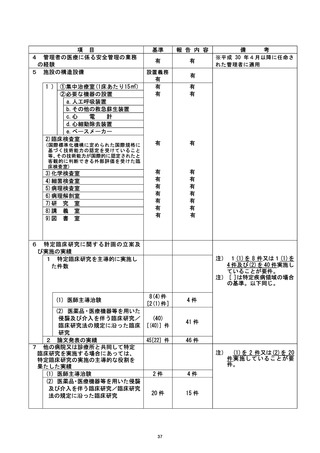
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
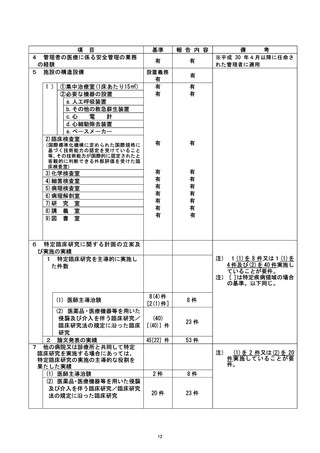
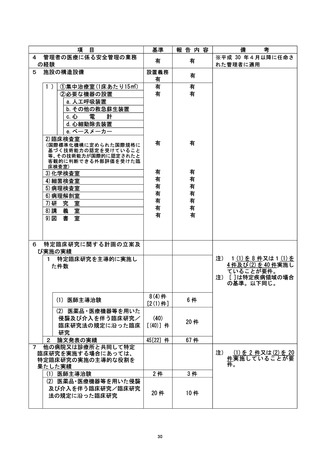
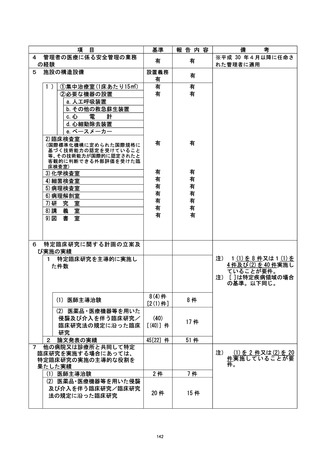
不適正事案に関する対応状況 :
①CRB の承認を受けたことにより試験開始可能と誤認のため、すみやかに jRCT 公表を
行った。
②全盲の対象者に対し、口頭説明にて研究内容の理解および同意が得られたが、直筆賭
名ができず、 対象者から代筆の依頼があったことから担当医師が代筆したが、 認定臣床
研究客査和本員会に誠り、 研究には直接関与していない者による代筆を認めるという一文
を研究計画書に追記することとなった。
③通常診療の同意書と同時に署名を取得した際に、 他の書類と同様に研究分担者ではな
い担当医師が署名をしてしまったことから、 臨床研究の同意書は通常診療のものと区別
し、研究分担医師の名により説明・同意を得ることを徹底する。
④術前の説明の際に書類をわたして後日回収を行うことにしていたが、その同意の有無
について把握が不十分であり、当日撮影に至ってしまっていた。この事案については、
研究分担医師の外来受診時に同意の確認が不十分なまま撮影が行われた状況について
説明し、ご本人にはご理解を頂いた。また本症例は逸脱とし、 解析には含めないことと
する。
なお、上記の内容については、重大な不適合として認定臨床研究審査委員会にて番議さ |
れた。 |
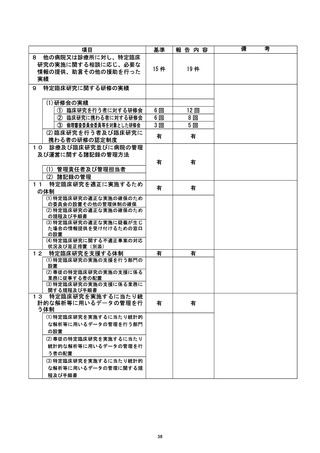
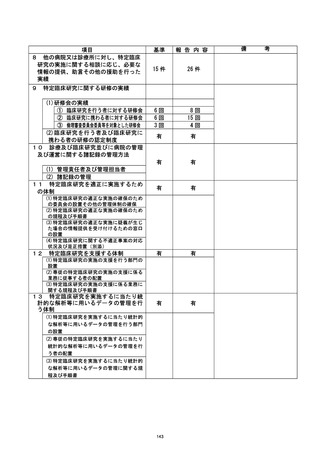
是正措置 :
①研究登録をする際に研究計画書に記載してある登録期間や研究期間などを確認し、 順
守する。
②直筆箸名が不可能な対象者に対しての代筆は、 公正な立会人にしていただくことを厳
守する。
③臨床研究の同意書は通常診療のものと区別 し、 研究責任医師・研究分担医師の名によ
り説明・同意を得ることを徹底する。
今回の研究においては、 症例集積がすでに終了しており、 今後症例が追加されること
はないが、 今後、このような事案が生じないよう診療科内で申し合わせている。
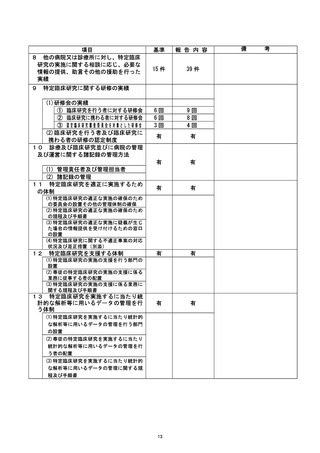
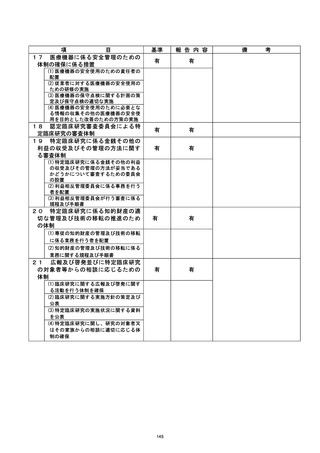
不適正事案の拓要 : 参考論文・根拠論文に関する特定不正行為
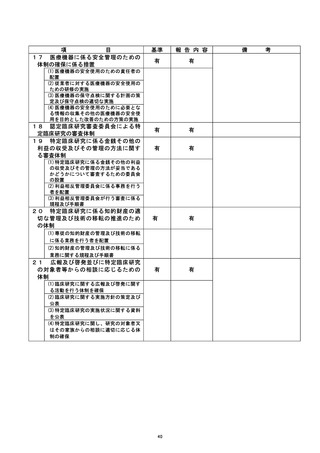
き録D 生還還還議 臨床研究名
不適正事案に関する対応状況 :
2020/5/12 当該臨床研究の参考論文の 1 つが特定不正行為と認定されたため、研究代
表医師は、 重大な不適合事案として認定臨床研究審査委員会(CRB) に報告と
した。
2020/5/20・6/3・6/15 (臨時) ・6/22 (臨時) CRB 開催・審議
研究代表医師より 5/12 報告のあった重大な不適合報告について、CRB は、
通常及び臨時開催において、鶴議の結果、患者保護の観点から試験計画を
変更し継続することで承認した。
2020/6/4 大阪大学医学部附属病院において実施される特定臨床研究の管理・監督業
務を補佐するために病院長が設置した大阪大学医学部附属病院臨床研究総
括委員会 (以下、「総括委上員会」という。) を開催・審議
総括委員会では、CRB の宮査の内容確認及び病院としての対応について検討
を行われた。
2020/7/9 第102 回先進医療技術審査部会に報告
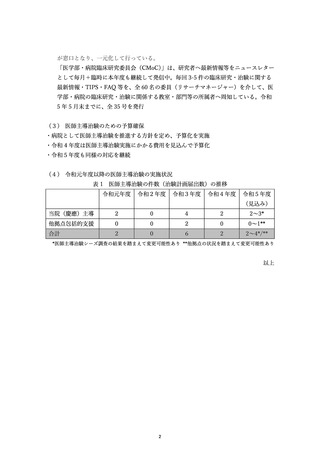
112