資料2:臨床研究中核病院業務報告内容確認表 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
| |
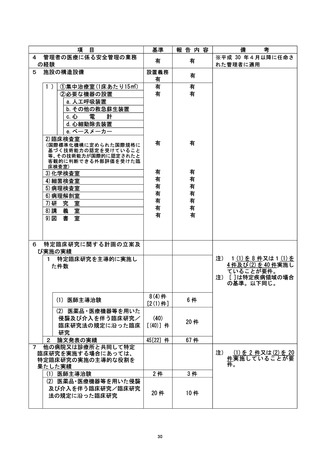
不適正事案の概要: ]
2021/6/23、研究計画書では試験薬(/アフリベルセプト)の投与基準が好中球数 1500/ | 以上
と規定されており、 当該研究対象者の好中球数は 1313/ル| であったが、試験薬を投与した。
投与基準を満たしていなかったが、日常臨床では投与可能な数値であると判断したこと、
FOLFIRI の投与基準のみを確認したことが原因であった。まず 2021/6/24 に病院長へ不適合
報告を行い、2021/8/20 に重大な不適合として再報告を行った。
不適正事案に関する対応状況:
事案判明後すぐに研究対象者に説明と謝罪を行った。また、試験薬投与による健康被害がな
かったことを確認した。 本事案は臨床研究法上の「重大な不適合」であるため、2021/9/2 の国
立大学法人北海道大学臨床研究容査委員会にて審議され、 詳細な検討の上で研究継続が
承認された。 2021/9/30 の特定臨床研究管理委員会(メール開催)における審議で、 健康被害
はなく、かつ了床研究法および施行規則等に明らかな違反はなかったが、臨床研究の信頼性
を軽微に損なう可能性があるため軽微な不適正事案と判断し、 研究責任医師に対し病院長か
ら文書注意を行った。
是正措置 :
再発防止策として、これまで担当医と CRC がそれぞれ別な場所で投与基準を確認していた
が、今後は担当医とCRC がそれぞれ確認したあと電話で再確認する体制とする。また共同研
究施設にも注意喚起を行う。
登録 Dp 等 還還還還還 治験・臨床研究名 |
|
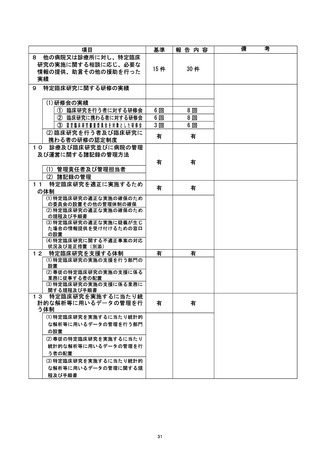
不適正事率の概要:
病院長が本院で実施される了攻床研究実施の適正性について自ら点検及び評価(以下、自己
点検)を実施した結果、以下の事案が判明し、2021/12/2 に病院長へ不適合報告を行った。
1) 研究対象者 1 名からインフォームド・コンセントを得る際に、最新の説明同意文書(Ver1.21)
を用いるべきところを、あやまって旧版(Ver1.2)を用いた。 使用した PC 内に両版が併存してい
たことが原因と考えられた。
2) 症例登録期間(て2021/10/31)をすぎて、4 例の新規症例登録を行った。 期間を研究開始
日(RCT 公開日)から 2 年後の 2021/12/1 までと誤認しており、 変更申請(期間延長)をせずに
症例登録を継続した。
不適正事案に関する対応状況:
該当するすべての研究対象者に説明の上、謝罪し、再同意を取得した。 2022/1/27 の特定臨
床研究管理委員会における審議で、1) 説明同意文書の変更点に研究参加の意思決定に影
般を及ぼすような記載がなかったこと、2) 症例登録日は登録期間を過ぎていたが研究実施
期間内であり、研究対象者から再同意を得る予定であることを確認した。 研究対象者に健康
被害はなく、 かつ了臨床研究法および施行規則等に明らかな違反はなかったが、臨床研究の信
頼性を軽微に損なう可能性があるため、軽役な不適正事案と判断した。
是正措置 :
再発防止策は以下のとおり。
1) 共有 PC から旧版の同意説明文書を削除した。 今後、IC の際には研究担当者と担当 CRC